서 론
염증은 외부 자극 또는 내부의 면역 질환에 의해 발생하는 것으로 세포가 자극을 받아 염증성 싸이토카인을 분비시킨다. 특히, CD4+ T(Helper T, Th) 세포는 림프절에서 항원제시세포(APC)를 만나 MHC class2와 항원을 인식하고 활성화되어 여러 싸이토카인을 분비하는데 분비된 싸이토카인은 적응면역의 세포들을 활성화시키고 선천면역의 반응에 영향을 미친다. 항원제시세포가 분비하는 싸이토카인에 따라 Th세포는 Th1, Th2, Th17, Th22로 나뉘어진다. T 세포가 항원제시세포에서 특정 사이토카인을 받아 CD4+ T세포를 5가지로 분화시키는데 이때 IL-4, IL-6 및 TNF-α와 같은 싸이토카인에 따라 Th 세포의 분화방향이 달라진다. 특히, 피부 아토피염을 일으키는 염증인자 중 IL-6 및 IL-17이 주요 타겟인자로 알려져 있으며(Esparza-Gordillo et al., 2013; Hijnen et al., 2013; Ilves et al., 2015; Santos et al., 2020), 이를 치료하고자 하는 연구가 천연물을 이용하여 다양하게 연구되고 있다(Che et al., 2020; Jang et al., 2009; Cha et al., 2012). 아토피성 피부염의 발생은 피부외벽에 발생된 자극에 의해 간지러움을 동반하며, 피부미용에 매우 부정적인 영향을 미친다. 특히 아토피성 피부염과 동반되는 홍반 및 두드러기 등과 같은 증상은 피부장벽이 파괴되는 질환을 동반하여 수분이 쉽게 증발하고 유해물질이 피부에 쉽게 침투될 수 있어 2차 피부질환 및 비장 내 면역인자의 변화를 야기시킨다(Yun et al., 2008; Cha et al., 2012).
최근 화장품 소재 연구에 따르면 과도한 염증에서 유발되는 싸이토카인을 억제하여 체내 균형을 유지시키기 위해 미생물발효물 또는 유용식물로부터 연구되고 있다(Mok et al., 2010). 머위(Petasites japonicu), 당귀(Angelica gigas) 및 삼채(Allium hookeri) 추출물을 이용한 천연소재 염증 억제제에 대한 연구등이 보고된 바 있다(Kim et al., 2006; Bae et al., 2012; Jang et al., 2002). 또한, 항염증 활성이 뛰어난 bioflavonoid 유도체들을 다량 확보하여 이를 이용한 기능성 화장품 소재 개발에 대한 연구가 검토되고 있다(Lee et al., 2013).
우리나라는 3면이 바다로 둘러쌓여 수산물을 획득할 수 있는 경로가 용이하며, 해조류는 우리나라 전체 수산물 중 20%의 생산량을 차지한다. 최근 해조류에 포함된 알긴산, 식이섬유 등이 정장작용, 비만억제, 항산화효과 및 항암작용이 밝혀지면서 해조류를 이용한 다양한 식품이 개발되고 있다(Jeong & Lee, 2014). 한국산 식용 해조류는 44종이 보고돼 있으나 실제로 식용이 이용되는 경우는 매우 한정적이며, 해조류 63과 178속 414종 중 실제로 60여 종만 보고되었다. 특히, 해조류 전체량에 16%만 가공되고 있어 부가가치를 크게 창출시키지 못하는 특징을 갖으며 대표적인 해조류는 김(2종), 미역, 다시마, 파래(2종), 톳, 모자반, 청각에 불과하며 한천 원료로 우뭇가사리가 이용된다(Kang & Kim, 2019). 해조류는 60-95% 수분으로 이루어졌으며, 탄수화물이 가장 많아 당질이 건물량 기준으로 거의 50% 이상, 단백질은 15% 이하이지만 녹조나 홍조 중에는 20%를 넘는 것도 있다. 하지만 해조류 단백질 이용률은 낮아 소화율이 40% 이하이며 그 이외의 단백질 품질도 표준단백질의 50% 이하이다. 해조 다당류는 바깥 층에서 미세한 섬유상의 결정 구조인 세포벽에 위치한 다당, 외벽을 덮고 있는 무정형 겔인 점질 다당, 세포 안에 있는 저장 다당의 세가지로 나눌 수 있다(Yang & Lee, 2016). 해조류에 포함된 폴리페놀 물질은 천연물 중에서 낮은 편이기 때문에 항산화 능력이 떨어지는 것으로 보고되었다(Song et al., 2011). 다만, 추출조건의 변화를 통해 성분의 함량의 변화가 확인되었고, 다양한 연구를 통해 항산화 가치를 증가시킬 수 있는 연구가 진행되고 있다(Jeong & Lee, 2014).
산말목의 갈조류는 2과 29종으로 이루어져있으며, 우리나라는 동해 중부 연안에서 갈조류인 쇠꼬리산말(Desmarestia viridis)이 출현하는 것으로 보고되었고(Jae et al., 2008), 동해안중부의 해조류군집에서 참산말(Desmarestia ligulate), 담배잎산말(Desmarestia dudresnayi subsp. tabacoides)이 해양수산생명자원 목록에 수록되어 있다. 산말에 대한 연구는 우리나라 연안의 군집조사에 대한 연구에 대한 보고가 많으며(Jae et al.,2008), 효소산화억제제 개발연구(Cho et al., 1994), 방사선 항암치료 보호효과(Lee et al., 2008) 등 기능성 연구가 진행되었으나 기능성이 뛰어나지 않아 스크리닝 실험으로만 그쳤다. 일부 연구보고를 통해 D-mannuronic acid가 참산말 내 함유되어 있음을 확인하였고, 현재까지 산말을 이용한 대표물질 또는 그 기능성에 대한 연구도 부족한 실정이다.
따라서 본 연구에서는 연구가 많이 이뤄지지 않은 3종류의 담배잎산말, 쇠꼬리산말 및 참산말 이용하여 기능성 탐색하고, 참산말의 대표물질 D-mannuronic acid의 항염활성을 탐색하고자 하였다.
재료 및 방법
1. 추출물 및 단일물질
실험에 사용된 담배잎산말, 쇠꼬리산말 및 참산말 추출물 3종은 MBRIS를 통해 국립해양생물자원관에서 분양받아 사용하였으며, D-mannuronic acid(DMA)는 sigma에서 구입하여 사용하였다.
2. 세포 독성 실험
DMEM 445 mL, FBS 50 mL, penicillin-streptomycin 용액 5 mL을 혼합하여 배양액을 제조하였다. 세포 배양은 37°C, 5% CO2조건에서 배양하였다. 추출물은 DMEM용액을 용매로 하여 Raw264.7 세포에 12.5, 25.0, 50.0, 100 μg/mL 농도로 제조하였다. 또한, B16F10 세포에 100 μg/mL 농도로 제조하였다.
세포독성실험은 MTT 분석을 이용하여 측정하였다. 96 well plate에 각 well 당 3.0×104 cell을 seeding하여 1일간 37°C, 5% CO2조건에서 세포를 배양하였다. 배양 후 상층액을 회수한 뒤 DMEM 배지 180 μL와 추출물 희석액을 20 μL 주입하여 다시 2일간 배양하였다. 배양 후 추출물 희석액을 회수한 뒤 MTT 용액을 100p씩 첨가하여 4시간 동안 결정화시켰다. 그 후 MTT 용액을 다시 제거한 뒤, DMSO 100 μL를 첨가하여 결정화된 MTT를 다시 용해시켜, 560 nm 흡광도를 통해 결정화된 MTT의 양을 측정하였다. MTT의 결정 생성은 NADH의 양과 비례하며, 생존한 세포수에 비례한다.
3. Nitric oxide(NO) 생성 억제능
NO 생성 억제능 실험에는 RAW 264.7 cell을 사용하였다. 세포 배양에는 DMEM, FBS, penicillin-streptomycin 용액을 사용하였으며, 염증반응을 유도하기 위하여 lipopolysaccharide (Sigma, USA)를 사용하였다. NO 생성 억제능은 griess reagent를 이용하여 측정하였다. Griess reagent는 1% sulfanilamide (TCI, Japan)를 5% phosphoric acid(Junsei, Japan)에 녹인 것과 0.1% naphthylethylenediamine dihydrochloride(TCI, Japan)수용액을 1: 1 비율로 혼합한 것을 사용하였다. DMEM 445 mL, FBS 50 mL, antibiotics 5 mL을 혼합하여 배양액을 제조하였다. 세포 배양은 37°C, 5% CO2조건에서 배양하였다. 추출물 희석액은 DMEM용액을 용매로 하여 12.5, 25.0, 50.0, 100 μg/mL 농도로 제조하였다.
96 well plate에 각 well 당 5.0×104 cell을 seeding하여 1일간 37°C, 5% CO2조건에서 세포를 배양하였다. 배양 후 상층액을 회수한 뒤 lipopolysaccharide(LPS)가 1 μg/mL 농도로 첨가된 DMEM 배지 180 μL와 추출물 희석액을 20 μL 주입하여 다시 2일간 배양하였다. 배양 후 추출물 희석액의 상층액 100 μL을 회수한 뒤 griess reagent을 100 μL씩 첨가하여 15분간 동안 반응시켰다. 그 후 540 nm 흡광도를 측정하였다. 540 nm 흡광도는 생성된 NO의 양과 비례한다. NO 생성 억제능의 계산은 다음과 같이 계산하였다.
4. 말초혈액 단핵세포를 이용한 CD4+ T세포 분리
사람 말초혈액에서 분리된 단핵세포(peripheral blood mononuclear cells, PBMC, Zen-bio, Research Triangle Park, NC)를 구매하여 CD4+ T 세포의 분리하기 위해 MACs bead를 이용해서 분리하였다. Anti-human CD4 biotin cocktail(Milteny biotec, Bergisch Gladbach, Germany)와 4°C에서 15분간 반응시킨 후 anti-human CD4 biotin Microbead(Milteny biotec)와 4°C에서 15분간 반응시킨 후 1%BSA(bovine serum albumin), 2 mM EDTA(Amresco)가 포함된 PBS 용액(pH 7.4)으로 세척하고 column(Milteny biotec)을 통과시켜 음성 분획으로 CD4+ T세포를 분리하였다. 분리된 세포를 PBS로 세척하고 10% 우태아 혈청이 포함된 RPMI1640(Gibco BRL) 세포 배양액에 재부유시켰다.
5. 세포자극 및 IL-17 염증기전 확인
추출물은 RPMI1640배지을 용매로 하여 12.5, 25.0, 50.0, 100 μg/mL 농도로 제조하였고, DMA는 dimethyl sulfoxide(DMSO)에 100 mM로 조제 후 RPMI1640 배지에 다시 1/10 희석하였다.
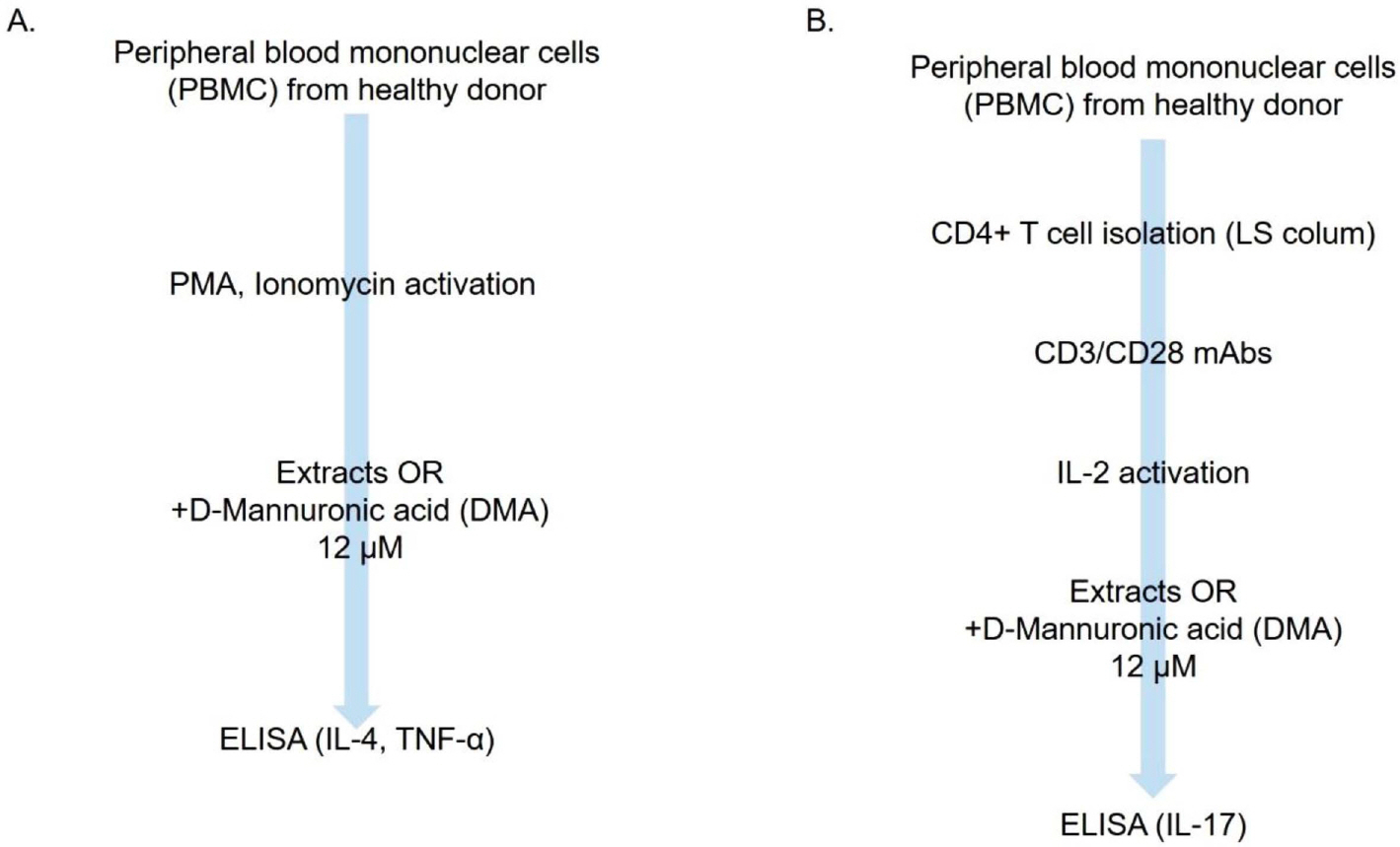
말초 혈액 단핵세포의 CD4+ T 세포 1×106/mL를 10% 우태아 혈청이 포함된 RPMI1640 세포배양액과 함께 anti-CD3 및 anti-CD28 Ab(BD phamigen, San Diego, CA)가 각각 2 μg/mL 코팅된 24 well plate(Costar, Cambrige, MA) 분주하고 IL-2 10 ng/mL(R&D, Minneapolis, MN)로 자극하여 24시간 동안 37°C 5% CO2 배양기에서 배양하였다. DMA 12 μM 또는 추출물 10.0 mg/mL로 배지를 조제 후 IL-2 10 ng/mL를 다시 배지에 추가하여 세포에 자극시킨 후 24시간 동안 37°C 5% CO2 배양기에서 추가 배양하였다. 배양배지 300 μL를 회수하여 2,000 rpm으로 원심분리 후 상층액만 회수하였다. 회수된 배지를 anti-human IL-17(R&D, Minneapolis, MN) ELISA kit를 이용하여 측정하였다(Fig. 1B).
6. IL-4 및 TNF-α 염증기전 확인
말초 혈액 단핵세포 3×106/mL를 10% 우태아 혈청이 포함된 RPMI1640 세포배양액에 PMA 1 mg/mL(Sigma, USA) 및 ionomycin 25 μg/mL(Sigma, USA)를 로 자극하여 4시간 동안 37°C 5% CO2 배양기에서 배양하였다(Guerrero-Arguero et al., 2020; Karlsson & Hassan-Zahraee, 2015). DMA 12 μM 또는 추출물 10.0 mg/mL로 배지를 조제 후 PMA 1 mg/mL 및 ionomycin 25 μg/mL를 다시 배지에 첨가하여 세포를 자극시킨 후 24시간 동안 37°C 5% CO2 배양기에서 추가 배양하였다. 단핵세포의 염증 반응기전을 확인하기 위해 배양배지 300 μL를 회수하여 2,000 rpm으로 원심분리 후 상층액만 회수하였다. 회수된 배지를 anti-human IL-4(R&D, Minneapolis, MN) 및 anti-human TNF-α ELISA kit를 이용하여 측정하였다(Fig. 1A).
7. 염증기전 유전자 확인
말초 혈액 단핵세포 3×106/mL를 10% 우태아 혈청이 포함된 RPMI1640 세포배양액에 PMA 1 mg/mL(Sigma, USA) 및 ionomycin 25 μg/mL(Sigma, USA)를 로 자극하여 4시간 동안37°C 5% CO2 배양기에서 배양하였다(Karlsson & Hassan-Zahraee, 2015). DMA 12 μM 또는 추출물 10.0 mg/mL로 배지를조제 후 PMA 1 mg/mL 및 ionomycin 25 μg/mL를 다시 배지에 첨가하여 세포를 자극시킨 후 24시간 동안 37°C 5% CO2 배양기에서 추가 배양하였다. 단핵세포의 IL-17염증 반응기전을 확인하기 위해 배양배지 300 μL를 회수하여 2,000 rpm으로 원심분리 후 상층액만 회수하였다.
8. RNA 추출
세포를 모두 2,000 rpm에 10분간 원심분리한 후 상층액을 제거하고 200 μL의 TRI reagent(Cat No. T9424, Lot No. BCCB9278, Sigma, USA)에 넣어 homogenization하였다. Homogenate를 실온에서 5분간 방치한 후 0.2 mL chloroform(Daejung Chemical, Korea)을 넣고 15 초간 vortex를 실시하였다. Vortex 후 4°C에서 13,000 rpm로 15분간 원심분리한 후 RNA가 포함되어 있는 투명한 상층액을 분리하였다. 분리한 상층액에 0.4 mL isopropanol(Daejung Chemical, Korea)을 넣고 섞은 후 실온에서 10분간 방치한 후 4°C에서 12,000 rpm으로 10분간 원심분리하여 RNA를 침전시켰다. 상층액을 제거한 후 1 mL 75% ethanol (Daejung Chemical, Korea)을 넣은 후 vortex하여 4°C에서 13,000 rpm으로 10분간 원심분리하여 RNA를 세척 후 RNA 펠렛을 10분간 공기 건조시켰다. 건조된 펠렛에 50 µL의 DEPC-treated DW(Welgene, Korea)로 용해시켜 cDNA 합성에 사용하였다.
9. cDNA 합성
cDNA synthesis는 Power cDNA synthesis kit(iNtRON, Korea)을 사용하여 실시하였다. RNA 1 µL(1 μg/µL)와 RNase-free water 8.5 µL를 섞은 후 1 µL의 random hexamer를 넣어 75°C에서 5분간 반응시켰다. RNA mixture를 spin down시킨 후 얼음 위에서 5분간 방치하고 RNase inhibitor 1 µL, 5x RT buffer 4 µL, dNTP mixture 2 µL, DTT 2 µL 및 AMV RT enzyme 0.5 µL를 순서대로 넣은 후에 42°C에서 60분 동안 반응시키고 70°C에서 5분간 가열하여 RNA: cDNA hybrid를 변성시킴으로써 반응을 정지시켰다.
10. qPCR
qPCR은 Prime Q-Master mix(GENET BIO, Korea)를 사용하여 실시하였다. Prime Q-Master mix 10 µL, forward primer(10 pM/µL) 2 µL, reward primer(10 pM/µL) 2 µL, sterilized DW 5µL 및 template DNA 1 µL를 차례대로 넣은 후 real-time PCR machine(model RG6000, Corbett, USA)을 이용하여 PCR을 실시하였으며, primer sequence는 inducible NO synthase(iNOS) 유전자는 F: GCAGGGCCACATCTATGTTT, R: CCTCAACCT GCTCCTCACTC를 이용하였고, myeloperoxidase(MPO) 유전자는 F: GACAACACAGGCATCACCAC, R: CCAGGTTCA ATGCAGGAAGT를 이용하였다.
결과 및 고찰
1. 산말 추출물의 raw264.7세포에서 세포독성 및 염증 조절
LPS는 toll-like receptor(TLR)을 통해 특정 분자를 감지하는 수용체단백질을 직접적으로 자극시키는 것이 아닌 CD14에 결합한 뒤 TLR4에서 그 결합을 인지하고 하위 신호를 전달하면서 염증반응을 보인다(Erridge et al., 2008; Fock et al., 2007). 마우스에서 분리된 Raw264.7와 같은 대식세포(macrophage)의 활성을 측정하는 방법 중 LPS에 의해 유도된 염증유발물인 iNOS의 발현, 싸이토카인(tumor necrosis factor alpha; TNF-α, Interleukin 1 beta; IL-1β, Interleukin 6)의 변화를 확인한다(Erridge et al., 2008; Fock et al., 2007; Su et al., 2020).
산말 추출을 이용한 raw264.7세포의 세포독성은 100 μg/mL 농도에서 모두 92% 이상의 세포생존률을 보였고(Fig. 2A), LPS에 의해 유도된 염증유발물질인 NO양을 참산말은 32.3 ±2.2%로 가장 낮게 측정되었고, 3종의 산말 중 가장 높은 억제율을 보였다(Fig. 2B). TNF-α 양은 참산말에서 543 ± 18 pg/mL로 가장 낮게 측정되었으며(Fig. 2C), IL-1β 양은 참산말에서 543 ± 18 pg/mL로 가장 낮게 측정되었고(Fig. 2D), IL-6 양은 참산말에서 43 ± 2 pg/mL로 가장 낮게 측정되었다(Fig. 2E). 산말 추출물 3종 중 참산말이 세포의 염증반응 물질을 감소효과가 큰 것을 확인했다.
Fig. 2.
Comparison of inflammatory cytokine release inhibition parameters: anti-inflammation activity. Abbreviations: D1, Desmarestia ligulate; D2, Desmarestia dudresnayi subsp. tabacoides; D3, Desmarestia viridis. Data are the mean ± SD of 3 independent experiments. ### P < 0.001, one-way ANOVA followed by Bonferroni test compared to ctrl, ∗∗∗ P < 0.001, one-way ANOVA followed by Bonferroni test compared to LPS.
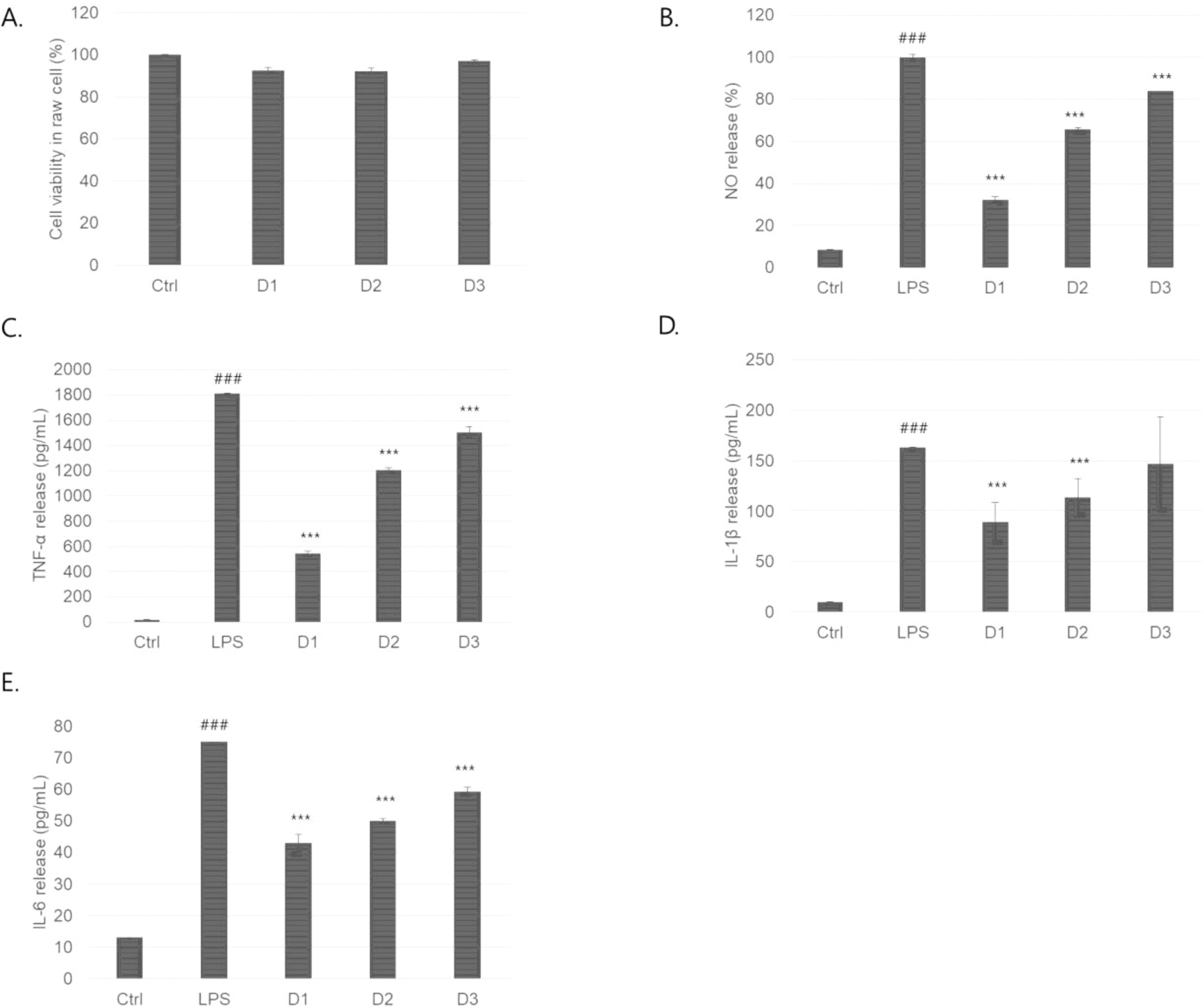
비슷한 연구로 베리 추출한 폴리페놀 물질을 이용하여 LPS에 의해 염증유도 된 raw264.7세포에 첨가시 nuclear factor-kappa B(NF-κB)에 의해 발생된 NO, TNF-α 및 IL-6를 억제하였으며(Gu et al., 2020), 민들레 추출물을 이용한 실험에서 염증성 싸이토카인 NO 및 TNF-α를 조절하는 것을 확인하였다 (Wang et al., 2015). 하지만, 항염증성 싸이토카인인 IL-1β도 염증성 싸이토카인처럼 참산말에서 감소시키는 것으로 보아 싸이토카인을 직접적으로 조절하는 것이 아닌 중간 매개가 있을것으로 사료된다.
2. 산말 추출물 및 DMA의 사람 말초혈액 단핵세포에서 세포독성 및 염증 조절
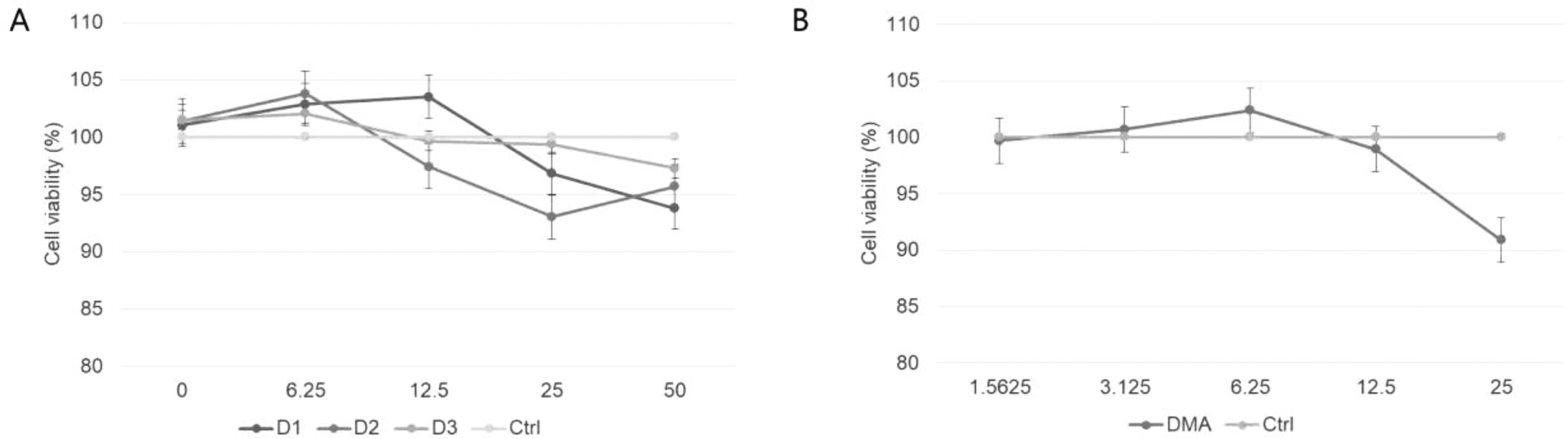
사람에서 분리된 단핵세포의 면역염증에서도 동일하게 참산말이 염증완화 효과를 보이는지 확인하기 위해 면역염증(알레르기)을 일으키는 작용모델을 실험에 이용하였다. 분리된 단핵세포를 이용하여 세포독성을 측정한 결과 산말추출물은 12.5 mg/mL 이하에서 100%의 세포 생존률을 보였고(Fig. 3A), 참산말의 표준물질은 DMA는 12.5 μM 이하에서 100%의 세포 생존률을 보였다(Fig. 3B).
Fig. 3.
Comparison of cell viability parameters: anti-toxicity activity. Abbreviations were the same as Fig. 1.
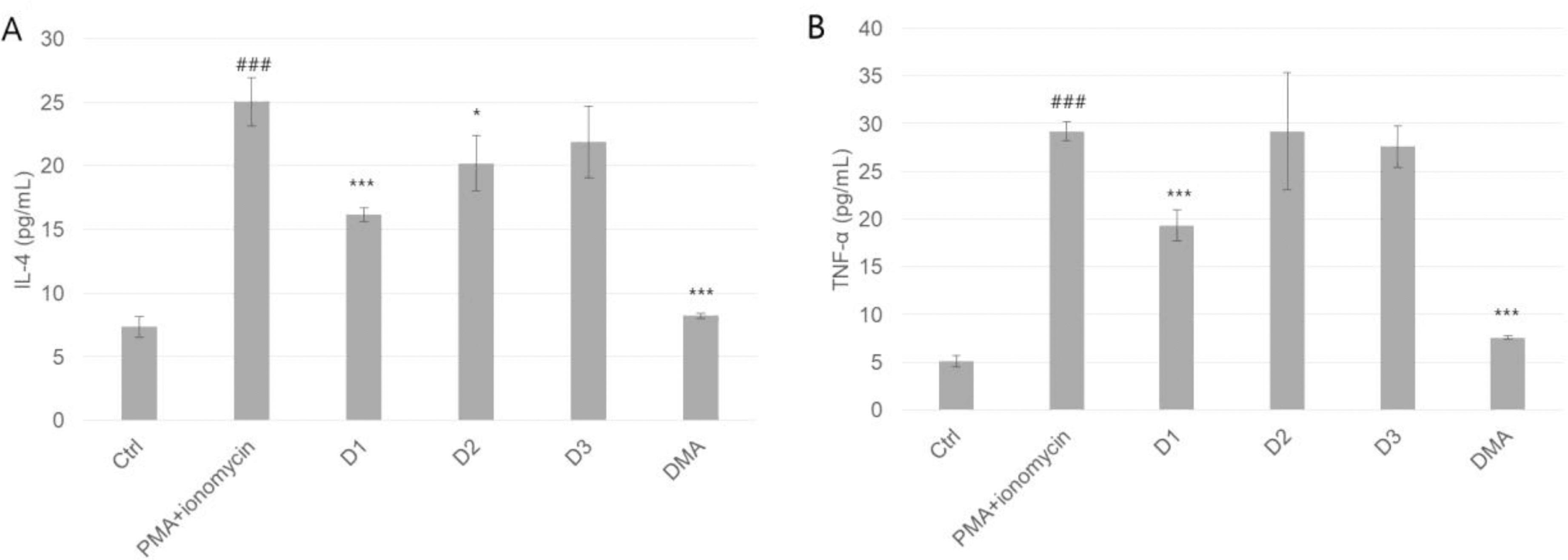
단핵세포를 이용하여 염증유도인자 PMA/ionomycin을 이용하여 염증작용을 유도시키고 DMA 12 μM 또는 추출물 10.0μg/mL 첨가시 Interleukin-4(IL-4)는 참산말에서 16.1 ± 1.9 pg/mL로 가장 낮게 측정되었고(Fig. 4A), TNF-α 역시 참산말에서 19.3 ± 1.6 pg/mL로 가장 낮게 측정되었다(Fig. 4A). 특히, DMA 첨가시 IL-4 및 TNF-α 측정 시 정상수치만큼 감소되는것을 확인했다.
Fig. 4.
Comparison of inflammatory cytokine release inhibition parameters in PBMC: anti-inflammation activity. Abbreviations were the same as Fig. 1. Data are the mean ± SD of 3 independent experiments. ### P < 0.001, one-way ANOVA followed by Bonferroni test compared to ctrl, ∗P < 0.05, ∗∗∗P < 0.001, one-way ANOVA followed by Bonferroni test compared to LPS.
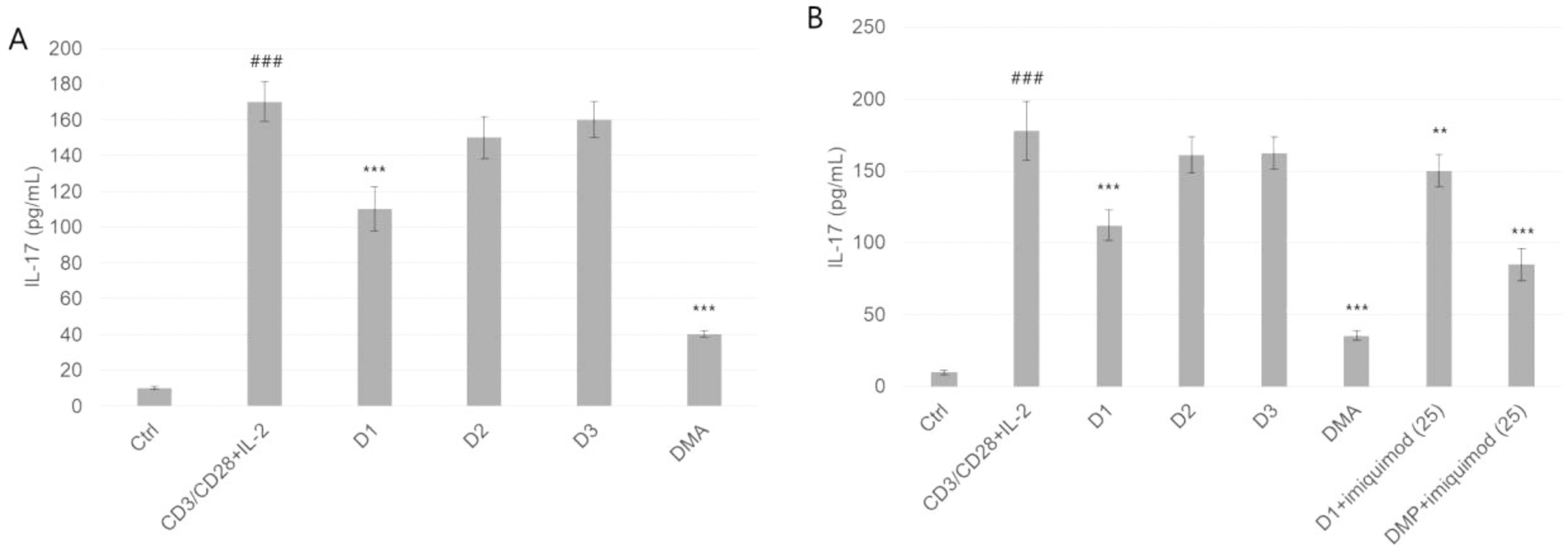
CD4+ T 세포에서 측정한 IL-17은 참산말에서 110.1 ± 12.5 pg/mL로 가장 낮게 측정되었고, DMA에서 40.1 ± 1.8 pg/mL로 참말 추출물 대비 4.2배가량 높은 억제효과를 보였다(Fig. 5A). IL-17 유도제인 imiquimod를 동시에 첨가한 경우 참산말 및 DMA의 IL-17 억제효과가 각각 1.3배 및 2.3배 증가되는 것을 확인했다(Fig. 5B).
Fig. 5.
Comparison of IL-17 cytokine release inhibition parameters in CD4+ T cell: anti-inflammation activity. Abbreviations were the same as Fig. 1. ### P < 0.001, one-way ANOVA followed by Bonferroni test compared to ctrl, ∗∗ P < 0.01, ∗∗∗ P < 0.001, one-way ANOVA followed by Bonferroni test compared to LPS.
박테리아 감염 및 다양한 면역 반응에서 T 세포가 매개하는 염증과 면역 반응들의 발달에서 IL-17는 T 세포, 선천성 면역세포들과 상피세포에 의해 생산된다. Th17은 중 IL-6, IL-21, IL23의 영향으로 Th17세포로 분화되어 IL-17을 분비한다(Tang et al., 2020). Th17세포가 줄어들면 만성염증을 유발하며, Th17세포가 많아지면 자가면역 질환 및 염증과 관련된 류마티스 관절염과 같은 다량의 염증을 유발한다. 최근 연구에서 lipopolysaccharide(LPS), peptidoglycans 및 zymosan와 같은 미생물 생산물들에 의해 자극받은 항원 제시 세포들이 다량의 IL-23을 생산하여 Th17 세포의 발달을 유도하기 때문에 Th17 세포들이 감염에 대한 숙주 방어에 관여할 것으로 제안되었다(Karlsson & Hassan-Zahraee, 2015). 또한, 이외의 다양한 자극 싸이토카인 또는 화학물질을 이용한 IL-17에 대한 연구가 보고된 바 있다. 다만, 천연물을 이용한 단핵세포에서 IL-17을 조절하는 연구는 아직 없었으며, IL-17 억제제는 천연물에서는 없었고 세쿠키누맙(secukinumab)이라는 약물 이외에는 현재까지 보고되지 않았다. 산말을 이용하여 IL-17을 억제하는 것을 확인하였고, 이는 IL-17을 조절하는 Th17세포로 분화시키는 TGF-β, IL-6, IL-21 및 IL23 중 IL-6의 조절이 영향을 준 것으로 판단된다(Tang et al., 2020; Zhang et al., 2018). 하지만, IL-21 또는 IL-23의 발현에 대한 연구도 필요할 것으로 보인다.
3. 산말 추출물 및 DMA의 사람 말초혈액 단핵세포의 염증반응 유전자 조절
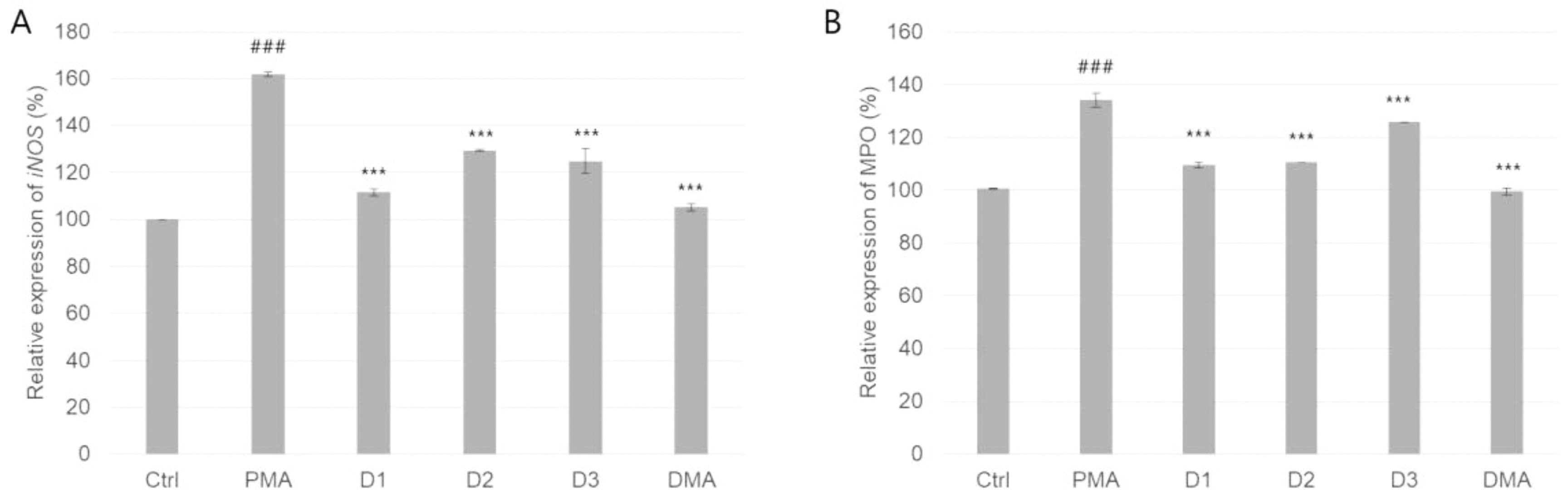
생체 내에서 염증 반응에 동반하는 NO 생성을 담당하는 효소인 iNOS는 싸이토카인에 의해 제어되며 이 때 생성되는 NO는 염증에서 화학적 매개체 역할로 작용한다(Tiwari et al.,2018). 또한, 위염과 같은 신체내 염증반응시 조직의 위축진행 및 MPO 유전자발현 다양성이 보고되었다(Galecki et al., 2012; Gao et al., 2016). 이 2가지 타겟은 염증에 의해 발생되는 타겟을 이용하여, 염증반응의 변화를 확인하였다. 분리된 단핵세포를 이용하여 염증반응 유전자 조절을 측정한 결과 참추출물에서 iNOS 유전자는 참산말에서 111.5 ± 1.4%로 가장 낮았으며(Fig. 6A), MPO 유전자는 참산말에서 111.5 ± 1.4%로 가장 낮았다(Fig. 6B). 또한, 두 유전자 모두 DMA를 첨가한 경우 정상레벨로 돌아오는 것을 확인했다.
Fig. 6.
Comparison of expression of free radical gene parameters: anti-inflammation activity. Abbreviations were the same as Fig. 1. ### P < 0.001, one-way ANOVA followed by Bonferroni test compared to ctrl, ∗∗∗ P < 0.001, one-way ANOVA followed by Bonferroni test compared to LPS.
강황의 커큐민(curcumin)은 iNOS, MPO를 감소시켜고, IL-6를 억제시키며, 그레이트프루트의 나리제닌(narigenin)은 iNOS를 감소시켜고, IL-6 및 IL-17을 감소시키는 것으로 알려졌다(Larussa et al., 2019). 염증유발 시 iNOS 또는 IL-6와 같은 염증유발물이 피드백을 통해 IL-17을 유발시키는 것으로 보고된 바있다(Li et al., 2018).
결 론
본 연구에서도 PMA에 의한 염증유발이 iNOS, MPO를 감소시켰고, 이때 자극된 CD3 및 IL-2을 감소시켜 IL-4, IL-6 및 IL-17을 저해시키는 것으로 판단된다. 참산말 및 DMA의 처리는 아토피 피부염을 완화시키고 2차적으로 발생시키는 염증을 완화시켜 피부질환에 도움을 줄 수 있을 것으로 사료된다. 특히, IL-17은 피부 각질세포(keratinocytes)의 과다증식을 유도하고, 혈관으로부터 호중구를 유도하여 만성염증을 유발하키고(Mercurio et al., 2020), 건선으로 발생된 피부 염증을 심화시키는 것으로 알려져 있기 때문에 건선이 있는 피부건조증을 유발하는경우 보습을 위한 화장품 사용이 필수적이다(Eyerich et al., 2018). 참산말 및 DMA가 포함된 화장품이 개발될 경우 IL-17 유래 건선이 유발되는 소비자 층에 유효한 화장품 소재가 될수 있으며, 아토피 피부염뿐 아니라 피부건조증 및 염증성 피부문제를 해결할 수 있는 새로운 화장품 소재로 개발 가능할것으로 보인다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print