|
 |
| J Korean Soc Cosmetol > Volume 27(4); 2021 > Article |
|
Abstract
This study attempted to investigate the functionality of Dactylosiphon bullosus, Sporochnus radiciformis, and Zonaria diesingiana extracts among algae as cosmetic ingredients. For this, antioxidant experiments were performed. D. bullosus, S. radiciformis and Z. diesingiana extracts were prepared with a 70% ethanol concentration to measure antioxidant activities. In terms of DPPH radical scavenging activity, Z. diesingiana was the highest with 94.20±0.28%. In ABTS radical scavenging activity, Z. diesingiana was the highest with 96.26±0.98%. In terms of the total phenolic contents and NO radical scavenging activity, Z. diesingiana was the highest with 47.19±2.07 mg gallic acid/g and 92.87±1.79%, respectively. The above results show that Z. diesingiana extract has the greatest antioxidant activity, confirming its potential as a cosmetic ingredient.
최근 기능성 화장품에 대한 관심이 늘어가는 가운데 항산화능과 폴리페놀 함량은 피부 미용에 있어 중요한 요소로 작용한다. 기능성 화장품은 식약처 정의에 따르면 미백, 주름 개선, 자외선보호, 모발의 색상 변화·제거 또는 영양공급, 피부나 모발의 기능 약화 개선에 도움을 주는 화장품을 말한다(Shim & Kim, 2020). 이 중 가장 큰 관심을 받는 화장품은 미백과 주름 개선 기능을 가진 화장품이다.
기능성 화장품에서 미백작용은 크게 5가지 기전을 통해 이루어지며 각각 멜라닌 생성 유전자의 억제, 멜라닌 생성 효소인 tyrosinase의 전사후처리 억제, tyrosinase의 활성 억제, 멜라노좀의 이동 억제, 턴오버 주기의 촉진 등이 있다(Ebanks et al., 2009).
이 중 기능성 화장품에서 가장 많이 사용되는 기전은 tyrosinase의 활성 억제이다. 멜라닌 합성에는 tyrosine을 산화시켜 L-DOPA 등 melanin 전구체를 합성하여야 하는데 이때 tyrosinase와 활성산소종이 필요하다(Costin & Hearing, 2007).
즉 항산화 물질을 통해 활성산소종을 소거하여 미백효과를 나타낼 수 있으며, 대표적으로 ascorbic acid를 미백 제품에 사용한다.
한편 주름 생성 혹은 피부 노화의 원인으로는 다양한 인자가 있으나 크게 내인성 노화와 외인성 노화로 나누어지며, 내인성 노화는 대사산물과 유전자, 호르몬 등 체내의 요소와 관련되어 있으며, 대사산물의 과생산, 유전자 결함, 호르몬 불균형에 의해 생성된 활성산소종이 MMP(Matrix metallopeptidases)를 활성화시켜 노화를 유발한다(Poljšak et al., 2012). 한편 외인성 요인은 자외선, 공기의 오염 등 체외의 요소를 말하며, MMP를 활성화시켜 노화를 유발한다(Poljšak & Dahmane, 2012). 이러한 이유로 피부 건강 및 노화 방지를 위해 다양한 노화의 중간 매개체인 활성산소종을 소거하고자 화장품에 다양한 생물에서 얻어진 항산화 물질을 첨가한다.
해조류(seaweed)는 거대조류(macroalgae)로서 육안으로 관찰할 수 있다는 점에서 단세포의 미세조류와 구별되며, 바다에서 생육하는 다세포 원생생물을 말한다(Lee et al., 2011). 거대조류에서 추출한 2,400종 이상의 물질이 의약, 식품 산업 등에 중요 성분으로서 이용되고 있다(Kumari et al., 2011). 또한 열량은 낮고 식이섬유, 비타민, 무기질이 풍부하고 불포화지방산과 필수아미노산이 많은 것이 특징이다(Jimenez-Escrig & GoniCambrodon, 1999).
한국은 삼면이 바다로 둘러싸여 있어 해조류 생산 부분이 전 세계 4위에 이를 만큼 이용 및 양식 산업이 발달해 있다(Kim & Lee, 2004). 동양 문화권에서 해조류는 주로 식품 형태로 소비되고 있고, 최근에는 해양 자원을 경제성 있는 신규 항산화 물질로 개발하는데 적극 활용하고 있다(Kim et al., 2008; Choi et al., 2020).
특히 해조류는 화장품 산업에 활용 가능성을 보이는데 최근 미용적 트렌드가 건강한 피부로 변화함에 따라 항산화능이나 항염 같은 목적을 둔 화장품에 대한 관심이 늘어가고 있다. 해조류는 DNA등의 피부 구성 물질을 손상시키는 free radical을 소거하는 항산화능을 지니고 있어, 화장품 산업에 사용 되는 소재로서 높은 가능성을 보인다(Park et al., 2020).
해조류의 구분은 서식환경 및 구성 성분과 광합성 색소에 따라 갈조류, 녹조류, 홍조류로 나눠진다(이신엽 등, 2011). 그 중 갈조류는 전 세계적으로 약 1,500종이 발견되었고, 해조류 중 가장 발달한 시스템을 가지고 있다고 알려져 있다(Mekinić et al., 2019).
갈조류는 항산화능, 페놀 성분, tylosinase 활성 억제능이 높아 산화적 손상을 줄이는데 주로 이용된다(Dang et al., 2017). 또한 phycocolloid, fucoidan, phlorotannins 생리활성물질을 가지고 있으며, 항응고, 항암, 항산화 등의 다양한 효과가 나타난다고 알려져 있다(Halliwell & Gutteridge, 1986).
생리활성물질중 폴리페놀계 물질들은 항산화, 항염, 고혈압 억제 등의 효과가 있는데 특히 갈조류 폴리페놀의 phlorotannins은 육상식물과 다르게 phloroglucinol(1,3,5-trihydroxybenzene)을 기본 구조로 하는 독특한 플리페놀 2차 대사산물을 포함하고 있어 항산화 능력은 물론 해조류의 다양한 생리활성에 기여한다고 알려졌다(Ferreres et al., 2012; Proestos & Varzakas, 2017). 이러한 이유로 화장품에서 항산화능은 가장 먼저 조사되어지는 특성 중 하나로, 항산화 물질을 화장품에 첨가함으로서 ROS에 의한 색소 과생산, 피부 노화, 염증 완화 등의 효과를 나타낸다(Cho et al., 2016; Moon et al., 2019; Park et al., 2019).
본 연구는 화장품 원료로의 사용 가능성을 보기위하여, 갈조류 중 하나인 Dactylosiphon bullosus(긴불레기말), Sporochnus radiciformis(털비말), Zonaria diesingiana(반주름말) 추출물에 대한 항산화능을 측정하였다.
DPPH assay에 사용된 2,2-diphenyl-1-picrylhydrazyl(DPPH)는 Sigma(USA)에서 구입하여 사용하였다.
ABTS assay에 사용된 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid(ABTS), ascorbic acid, manganese dioxide는 Sigma (USA)에서 구입하여 사용하였다.
Total phenolic contents assay에 사용된 Folin-Ciocâlteu reagent, Gallic acid, Sodium carbonate, Trichloroacetic acid는 Sigma(USA)에서 구입하여 사용하였다.
Nitric oxide(NO) radical scavenging activity assay에 사용된 sulfanilamide, naphthylethylenediamine dihydrochloride는 TCI (Japan)에서, phosphoric acid는 Junsei(Japan)에서 구입하여 사용하였다.
실험에 사용된 D. bullosus, S. radiciformis, Z. diesingiana 추출물은 해양수산부의 해양생명자원 정보 표준화 및 통합 데이터베이스 시스템인 해양생명자원 정보시스템(Marine BioResource Information System, MBRIS)를 통해 분양받아 사용하였다. 실험에 사용된 추출물은 70% ethanol로 추출한 뒤 이를 건조시켜 분말화하여 제조하였다.
DPPH radical scavenging activity는 Blois(1958)의 방법에 준하여 항산화력을 측정하였다. 각 추출물은 1.25, 2.5, 5, 10, 20 mg/mL의 농도가 되도록 70% ethanol로 희석하여 사용하였다. DPPH는 95% ethanol에 희석하여 520 nm에서 흡광도가 0. 5가 되도록 조정하였다. 추출물 용액 0. 20 mL와 DPPH 용액 1. 80 mL를 test tube에 주입 후 혼합하여 30분간 반응시켰다. 반응물은 UV-vis spectrophotometer(Ultrospec 3100 pro, GE Healthcare, USA)를 이용하여 520 nm에서 흡광도를 측정하였다. 양성 대조군으로는 ascorbic acid를 사용하였다. DPPH radical scavenging activity는 시료첨가구와 무첨가구의 흡광도를 구하여 아래와 같이 백분율로 표시하였다.
ABTS radical scavenging activity는 Re(1999)의 방법을 수정하여 항산화력을 측정하였다. 각 추출물은 1.25, 2.5, 5, 10, 20 mg/mL의 농도로 70% ethanol로 희석하여 사용하였다. ABTS는 2.5 mM 농도로 pH 7.40인 5 mM PBS에 희석한 뒤 oxidizing agent로서 manganese dioxide를 첨가하여 발색시켰다. 740 nm에서 흡광도가 0.6 이상이 되도록 발색이 되면 Whatman no. 2 filter paper를 이용하여 manganese dioxide를 제거한 후 흡광도가 0. 5가 되도록 pH 7.40인 5 mM PBS으로 희석하였다. 추출물 용액 0.20 mL와 ABTS 용액 1.80 mL를 test tube에 주입 후 혼합하여 30분간 반응시켰다. 반응물은 UV-vis spectrophotometer(Ultrospec 3100 pro, GE Healthcare, USA)를 이용하여 740 nm에서 흡광도를 측정하였다. 양성 대조군으로는 ascorbic acid를 사용하였다. ABTS radical scavenging activity는 시료첨가구와 무첨가구의 흡광도를 구하여 아래와 같이 백분율로 표시하였다.
Total phenolic contents는 Folin & Denis(1912)의 실험 방법을 변형하여 사용하였다. 각 추출물은 1. 0 mg/mL 농도로 70% ethanol로 희석하여 사용하였다. NaCO3 포화용액은 증류수에 과량의 sodium carbonate를 용해시킨 뒤, Whatman no. 2 filter paper를 이용하여 녹지 않은 sodium carbonate를 제거하였다. 추출물 0.02 mL와 Folin-Ciocâlteu reagent 0.01 mL, sodium carbonate 포화용액 0.06 mL를 micro tube에 주입한 뒤 15분간 반응시켰다. 그 후 증류수 0.20 mL를 주입하여 원심분리 후 상층액을 분리하였다. 반응물은 UV-vis spectrophotometer(Ultrospec 3100 pro, GE Healthcare, USA)를 이용하여 740 nm에서 흡광도를 측정하였다. 양성 대조군으로는 gallic acid를 사용하였다.
각 추출물은 1.25, 2.5, 5, 10, 20 mg/mL의 농도가 되도록 70% ethanol로 희석하여 사용하였다. NO radical scavenging activity는 griess reagent를 이용하여 측정하였다(Green et al., 1982). Griess reagent는 1% sulfanilamide를 5% phosphoric acid에 녹인 것과 0.1% naphthylethylenediamine dihydrochloride 수용액을 1 : 1 비율로 혼합한 것을 사용하였다. NO 생성 물질로는 0.1 M sodium nitrite 용액을 사용하였으며, 이를 희석하여 아래의 실험 방법을 통해 흡광도 1.0이 나오도록 보정하였다.
Sodium nitrite용액 0.9 mL와 추출물 0.1 mL를 혼합 후 30분 간 실온에서 반응시켰다. 반응이 끝난 용액 중 상층액 0.1 mL와 griess reagent 0.1 mL를 혼합하여 15분간 동안 발색이 이루어지도록 반응시켰다. 그 후 540 nm 흡광도를 측정하였다. 540 nm 흡광도는 생성된 NO의 양과 비례한다.
NO radical scavenging activity의 계산은 다음과 같이 계산하였다.
DPPH는 유기용매 또는 수용성의 추출물 항산화 활성 측정법으로 널리 이용되고 있다(Choi & Shin, 2015). DPPH radical scavenging activity는 항산화 물질의 전자공여능으로 인해 아민류 및 방향족 화합물에 의해 환원되어 보라색의 탈색 정도를 지표로 하는 항산화능 측정 방법이다(Choi et al., 2003). 이 실험 또한 보라색을 띄는 radical 상태의 DPPH 시약이 항산화 작용을 통해 radical이 소거되어 노란색으로 환원되는 원리를 이용하여 측정하였다(Kang et al., 2018).
갈조류 추출물의 DPPH radical scavenging activity을 측정한 결과 Table 1, Fig. 1과 같다. 갈조류 추출물의 DPPH radical scavenging activity 측정 결과 추출물의 농도와 radical scavenging activity이 비례한 결과를 보였다. D. bullosus 추출물은 1. 25 mg/mL에서 4.00±2.84%, 2.5 mg/mL에서 8.00±2.86%, 5.0 mg/mL에서 14.86±3.92%, 10 mg/mL에서 29.54±3.62%, 20 mg/mL에서 58.20±3.12%의 radical scavenging acivity를 보였다. S. radiciformis 추출물은 1.25 mg/mL에서 2.66±0.96%, 2.5 mg/mL에서 3.94±1.80%, 5.0 mg/mL에서 9.86±2.04%, 10 mg/mL에서 40.60±2.70%, 20 mg/mL에서 77.34±1.09%의 radical scavenging acivity를 보였다. Z. diesingiana 추출물은 1.25 mg/mL에서 9.34±1.41%, 2.5 mg/mL에서 18.14±1.20%, 5.0 mg/mL에서 35.60±1.02%, 10 mg/mL에서 71.80±1.42%, 20 mg/mL에서 94.20±0.28%의 radical scavenging activity를 보였다.
20 mg/mL 농도에서 Z. diesingiana 추출물은 94.20±0.28%로 D. bullosus 추출물의 58.20±3.12%에 비해 높고, S. radiciformis 추출물의 77.34±1.09%에 비해 높아 Z. diesingiana 추출물이 가장 뛰어난 DPPH radical scavenging activity를 보였다. 이는 동일한 갈조류인 Ecklonia cava의 DPPH radical scavenging activity인 87.2%보다 높은 DPPH radical scavenging activity를 나타내었다(Athukorala et al., 2006).
ABTS는 비교적 안정한 상태의 free radical로, DPPH보다 여러 가지 방법을 통한 radical scavenging activity을 측정할 수 있어, 다양한 시료에 이용할 수 있다. ABTS radical scavenging activity은 청록색의 ABTS radical이 항산화 물질을 포함하고 있는 추출물과 반응해 연한 녹색으로 변하는 원리를 적용한 측정 방법이다(Lee & Lee, 2017). ABTS radical scavenging activity 경우 소수성 물질과 친수성 물질의 antioxidative activity 측정이 가능하므로 일반적으로 DPPH radical scavenging activity보다 폭 넓은 물질에 대해 활성을 나타낸다(Re et al., 1999).
갈조류 추출물의 ABTS radical scavenging activity을 측정한 결과, 추출물의 농도가 증가함에 따라 ABTS radical scavenging activity 또한 증가하는 것을 확인하였으며, 그 결과는 Table 2와 Fig. 2와 같다. D. bullosus 추출물은 1.25 mg/mL에서 2.14±2.00%, 2.5 mg/mL에서 3.00±1.18%, 5.0 mg/mL에서 8.46±1.91%, 10 mg/mL에서 16.14±2.32%, 20 mg/mL에서 33.74±2.58%의 radical scavenging activity를 보였다. S. radiciformis 추출물은 1.25 mg/mL에서 4.34±2.16%, 2.5 mg/mL에서 7.00±1.07%, 5.0 mg/mL에서 14.20±2.86%, 10 mg/mL에서 32.60±3.80%, 20 mg/mL에서 61.54±1.72%의 radical scavenging activity를 보였다. Z. diesingiana 추출물은 1.25 mg/mL에서 2.34±1.32%, 2.5 mg/mL에서 24.46±0.98%, 5.0 mg/mL에서 71.46±0.34%, 10 mg/mL에서 93.20±0.16%, 20 mg/mL에서 96.26±0.98%의 radical scavenging activity를 보였다.
20.0 mg/mL 농도에서 Z. diesingiana 추출물은 96.26±0.98%로 D. bullosus 추출물의 33.74±2.58%에 비해 높고 S. radiciformis 추출물의 61.54±1.72%에 비해 높아 Z. diesingiana 추출물이 가장 뛰어난 ABTS radical scavenging activity를 보였다. 이는 동일한 갈조류인 Ecklonia cava의 ABTS radical scavenging activity인 35.6%보다 높은 ABTS radical scavenging activity를 나타내었다(Athukorala et al., 2006).
다양한 antioxidant가 함유되어 있는 천연물 추출물에는 종류에 따라 차이가 있으나 total phenolic content가 차지하는 비율이 높음으로 phenolic content의 양을 측정해 추출물의 항산화능을 유추할 수 있다(Singleton & Rossi, 1965).
이에 갈조류 추출물의 total phenolic contents를 측정하였다. 갈조류 추출물의 total phenolic content를 측정한 결과 Table 3, Fig. 3과 같다. 갈조류 추출물 중 1 mg/mL에서 D. bullosus는 41.84±1.49 mg gallic acid/g, S. radiciformis는 36.27±2.06 mg gallic acid/g, Z. diesingiana는 47.19±2.07 mg gallic acid/g의 결과를 보였다.
선행논문(Kim et al., 2006)에서 해조류 7종 구멍쇠미역(Agarum cribrosum), 곰피(Ecklonia stolonifera), 지누아리(Grateloupia filicina), 재래종다시마(Kjellmaniella crassifolia), 김(Porphyra tenera), 괭생이모자반(Sargassum horneri), 고리매(Scytosiphon lomentaria)의 total phenolic contents를 측정 결과 구멍쇠미역은 10.84 mg/g, 곰피는 2.44 mg/g, 지누아리는 1. 57 mg/g, 재래종다시마는 1.12 mg/g, 김은 0.35 mg/g, 괭생이모자 반은 7.22 mg/g, 고리매는 0.37 mg/g를 보였다. 이 중 갈조류에 해당하는 구멍쇠미역과 괭생이모자반이 각각 10.84 mg/g과 7.22 mg/g으로 나타났다. 이에 비해 본 실험에서 취급한 3종의 갈조류 추출물은 D. bullosus, S. radiciformis, Z. diesingiana 순 서로 41.84±1.49 mg gallic acid/g, 36.27±2.06 mg gallic acid/g, 47.19±2.07 mg gallic acid/g 결과로 앞선 연구의 해조류 7종의 결과와 비교했을때 모두 높은 수치를 보였는데 특히나 Z. diesingiana 추출물은 함량이 가장 높다고 나타난 구멍쇠미역에 비해 약 4배 이상의 결과로 total phenolic content가 매우 높은 것으로 나타났다.
NO는 적정한 농도에서 혈관의 확장, 향균, 신경의 신호전달, 항암효과를 지니는데 NO에 만성적으로 노출되었을 때 reactive oxygen species와 반응하여 높은 독성의 ONOO−가 생성될 가능성이 높아진다(Bhaskar & Balakrishnan, 2009; Amaeze et al., 2011). NO 또한 reactive oxygen species와 마찬가지로 항산화 물질에 의해 소거된다고 알려져 있다(Lakhanpal & Rai, 2007).
이에 갈조류 추출물의 NO radical scavenging activity을 보기 위해 갈조류 추출물을 용액에 반응시켜 측정하였다. 갈조류 추출물의 NO radical scavenging activity을 측정한 결과 Table 4, Fig. 4와 같다. D. bullosus 추출물은 1.25 mg/mL에서 4.87±1.92%, 2.5 mg/mL에서 10.23±0.59%, 5.0 mg/mL에서 20.63±1.70%, 10 mg/mL에서 42.90±1.65%, 20 mg/mL에서 70.63±1.70%를 보였다. S. radiciformis 추출물은 1. 25 mg/mL에서 5.33±1.35%, 2.5 mg/mL에서 9.27±1.14%, 5.0 mg/mL에서 17.53±0.95%, 10 mg/mL에서 35.37±1.09%, 20 mg/mL에서 67.93±1.68%를 보였다. Z. diesingiana 추출물은 1.25 mg/mL에서 4.97±1.52%, 2.5 mg/mL에서 13.13±1.09%, 5.0 mg/mL에서 26.50±1.84%, 10 mg/mL에서 51.80±1.42%, 20 mg/mL에서 92.87±1.79%를 보였다.
20.0 mg/mL 농도에서 Z. diesingiana 추출물은 92.87±1.79%로 D. bullosus 추출물의 70.63±1.70%에 비해 높고 S. radiciformis 추출물의 67.93±1.68%에 비해 높아 Z. diesingiana 추출물이 가장 뛰어난 NO radical scavenging activity를 보였다.
해조류 35종 추출물의 nitrite 소거활성 평가(Ahn et al., 2011)의 연구 논문 내용 중 갈조류의 17종(감태(Ecklonia cava), 곰피(Ecklonia stolonifera), 패(Ishige okamurai), 불레기말(Colpomenia sinuosa), 쇠미역(Costaria costata), 대황(Eisenia bicyclis), 톳(Hizikia fusiforme), 넓패(Ishige foliacea), 다시마(Laminaria japonica Areschong), 알쏭이모자반(Sargassum confusum), 모자반(Sargassum fulvellum), 짝잎모자반(Sargassum hemiphyllum), 괭생이모자반(Sargassum horneri), 지충이(Sargassum thunbergii), 야마자모자반(Sargassum yamade), 고리매(Scytosiphon lomentaria), 미역(Undaria pinnatifida))의 NO radical scavenging activity 경우 11종이 70% 이상의 활성을 나타내었다고 보고되었다.
본 실험 연구 결과 또한 D. bullosus 추출물이 70.63±1.70%, S. radiciformis 추출물이 67.93±1.68%의 수치로 선행 연구의 결과와 유사한 한편 Z. diesingiana 추출물의 경우 92.87±1.79%를 보여 높은 radical scavenging activity을 나타냄을 알 수 있었다.
본 연구에서는 DPPH radical scavenging activity, ABTS radical scavenging activity, total phenolic contents, NO radical scavenging activity를 측정하였다. DPPH와 ABTS radical scavenging activity 경우 radical activity에 따라 흡광 파장이 달라지는 물질을 이용하여 항산화능을 측정하는 방법으로, DPPH, ABTS는 활성산소와 유사하게 radical로서 작용을 한다(Floegel et al., 2011). 한편 phenolic contents 측정은 항산화능을 나타내는 것으로 알려진 polyphenol의 농도를 측정하여 항산화능을 간접적으로 측정하는 방법이며 주로 식물 추출물에 이용된다(Scalzo et al., 2005). 마지막으로 NO 소거능 측정은 추출물이 nitrite 염에 의해 만들어진 활성질소종을 소거시키는 것을 측정하는 것이다(Karmakar et al., 2011).
화장품에서는 간접적인 phenolic content 측정과 NO 소거능 측정보다 광범위한 항산화능을 측정할 수 있는 DPPH와 ABTS radical scavenging activity가 선호되며, 서로간 측정수치의 차이가 있어 두 방법을 모두 시행하는 것이 추천된다(Floegel et al., 2011).
갈조류 에탄올 추출물의 항산화능을 측정하기 위해 D. bullosus, S. radiciformis, Z. diesingiana 추출물의 항산화능을 측정하였다.
DPPH radical scavenging activity의 측정 결과 20 mg/mL 농도에서 Z. diesingiana 추출물은 94.20±0.28%로 D. bullosus 추출물의 58.20±3.12%에 비해 높고, S. radiciformis 추출물의 77.34±1.09%에 비해 높아 Z. diesingiana 추출물이 가장 뛰어난 DPPH radical scavenging activity를 보였다.
ABTS radical scavenging activity 측정 결과 20.0 mg/mL 농도에서 Z. diesingiana 추출물은 96.26±0.98%로 D. bullosus 추출물의 33.74±2.58%에 비해 높고 S. radiciformis 추출물의 61.54±1.72%에 비해 높아 Z. diesingiana 추출물이 가장 뛰어난 ABTS radical scavenging activity를 보였다.
DPPH radical scavenging activity에서 높은 효과를 나타냈던 Z. diesingiana 추출물은 ABTS radical scavenging activity에서도 높은 효과를 보여, Z. diesingiana 추출물이 DPPH, ABTS에서 모두 가장 높은 radical scavenging activity를 나타냈다.
Total phenolic content 측정 결과 D. bullosus는 41.84±1.49 mg gallic acid/g, S. radiciformis는 36.27±2.06 mg gallic acid/g, Z. diesingiana는 47.19±2.07 mg gallic acid/g의 결과를 보였으며, Z. diesingiana가 가장 높은 수치를 나타내었다.
NO radical scavenging activity 측정 결과 20 mg/mL에서 20.0 mg/mL 농도에서 Z. diesingiana 추출물은 92.87±1.79%로 D. bullosus 추출물의 70.63±1.70%에 비해 높고 S. radiciformis 추출물의 67.93±1.68%에 비해 높아 Z. diesingiana 추출물이 가장 뛰어난 NO radical scavenging activity를 보였다.
본 연구의 3종의 갈조류 실험 결과 Z. diesingiana 추출물이 모든 실험 방법에서 가장 뛰어난 항산화능을 보여 기능성 화장품 소재 개발에 중요한 자료로 사용 될 것으로 사료된다. 화장품의 원료로서 항산화능은 ROS를 소거시키는 능력을 통해 미백, 염증에 의한 피부 손상 방지, 피부 노화 방지, 주름 방지 등의 특성을 지닌다(Cho et al., 2016; Moon et al., 2019; Park et al., 2019). 동시에 지방성분의 산패를 막아, 화장품의 변성을 방지하는 특성을 지녀 제조상에도 큰 도움이 될 수 있다(Shahidi & Zhong, 2010). 이에 항산화능이 높은 Z. diesingiana 추출물을 이용함으로서 해양 자원을 이용한 화장품 개발에 도움이 될 것으로 예상된다.
Fig. 1.
DPPH radical scavenging activity of brown algae extract. Abbreviations were the same as Table 1
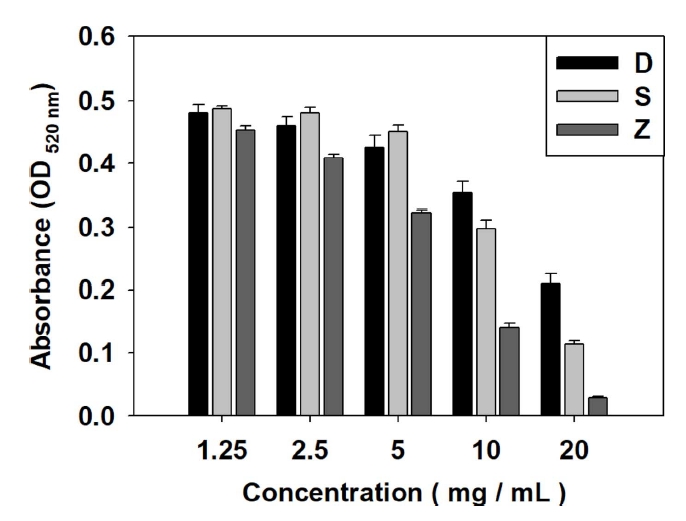
Fig. 2.
ABTS radical scavenging activity of brown algae. extract. Abbreviations were the same as Fig. 1.
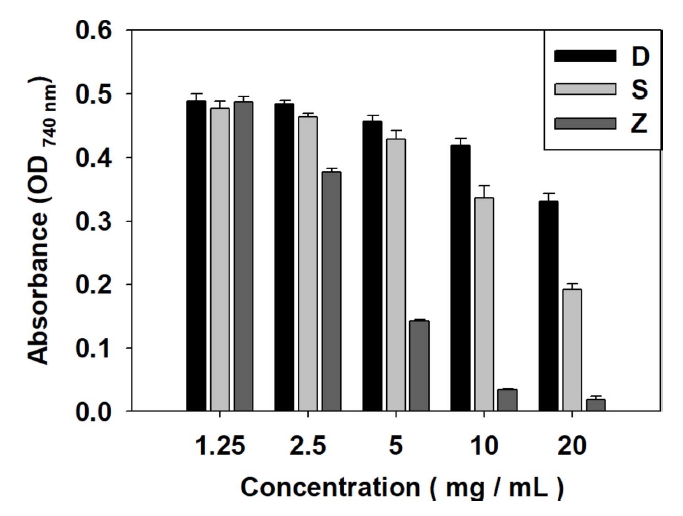
Fig. 3.
Total phenolic content of brown algae extract (Gallic acid used as standard). Abbreviations were the same as Fig. 1.
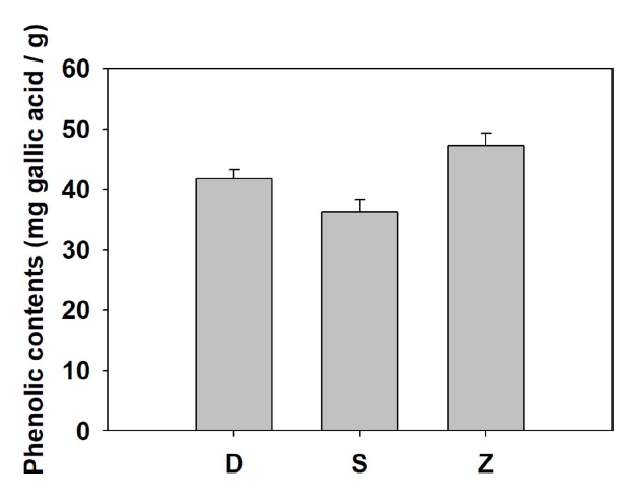
Fig. 4.
NO radical scavenging activity of brown algae extract. Abbreviations were the same as Fig. 1.
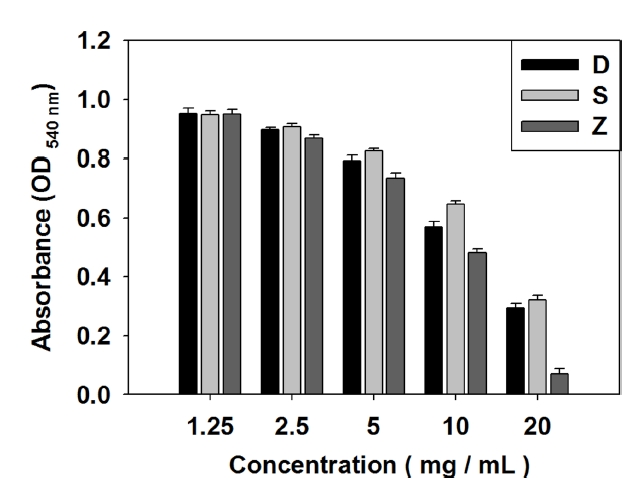
Table 1.
Mean and standard deviation of DPPH radical scavenging activity of brown algae extract
Table 2.
Mean and standard deviation of ABTS radical scavenging activity of brown algae extract
Abbreviations were the same as Table 1.
Table 3.
Mean and standard deviation of total phenolic contents of brown algae extract (Gallic acid used as standard)
| Concentration (mg gallic acid/g) | S.D | ||
|---|---|---|---|
| D | 41.84 | ± | 1.49 |
| S | 36.27 | ± | 2.06 |
| Z | 47.19 | ± | 2.07 |
Abbreviations were the same as Table 1.
Table 4.
Mean and standard deviation of NO radical scavenging activity of brown algae extract
Abbreviations were the same as Table 1.
REFERENCES
Ahn, S. M., Hong, Y. K., Kwon, G. S., & Sohn, H. Y. (2011 Evaluation of Antioxidant and Nitrite Scavenging Activity of Seaweed Extracts. Journal of Life Science, 21(4), 576-583. doi: 10.5352/JLS.2011.21.4.576.

Amaeze, O. U., Ayoola, G. A., Sofidiya, M. O., Adepoju-Bello, A. A., Adegoke, A. O., & Coker, H. A. B. (2011 Evaluation of antioxidant activity of Tetracarpidium conophorum (Müll. Arg) Hutch & Dalziel leaves. Oxidative Medicine and Cellular Longevity, 2011:doi: 10.1155/2011/976701.

Athukorala, Y., Kim, K. N., & Jeon, Y. J. (2006 Antiproliferative and antioxidant properties of an enzymatic hydrolysate from brown alga, Ecklonia cava. Food and Chemical Toxicology, 44(7), 1065-1074. doi: 10.1016/j.fct.2006.01.011.


Bhaskar, H., & Balakrishnan, N. (2009 In vitro antioxidant property of laticiferous plant species from Western Ghats Tamilnadu, India. International Journal of Health Research, 2(2), doi: 10.4314/ijhr.v2i2.55413.

Blois, M. S. (1958). Antioxidant Determinations by the Use of a Stable Free Radical. Nature, 181(4617), 1199-1200.

Cho, I. J., Kim, M. S., Cho, Y. J., & Kang, S. M. (2016). Antioxidant Activities microbial Effects of Omija (Schizandra chinensis) Flesh and Seed Extracts against Human Skin Pathogens. Jounal of The Korean Society of Cosmetology, 22(2), 255-262.
Choi, H. Y., Choi, N. Y., Son, M. S., Kim, D. S., & Lee, H. J. (2020 Assessment of the possibility as Cosmetics Materials by Brown algae from Jeju Island Using Supercritical Fluid System. Journal of the Korea Academia-Industrial Cooperation Society, 21(1), 698-704. doi: 10.5762/KAIS.2020.21.1.698.
Choi, J. S., Song, E. S., Kim, J. S., & Kang, M. H. (2003). Antioxidative Activities of Castanea Crenata Flos. Methanol Extracts. Korean Journal of Food Science and Technology, 35(6), 1216-1220.
Choi, M. H., & Shin, H. J. (2015). Anti-oxidative and Anti-melnogenesis Effects of Buleberry Extract. Korean Journal of Aesthetics and Cosmetics Society, 13(2), 261-266.
Costin, G. E., & Hearing, V. J. (2007 Human skin pigmentation: melanocytes modulate skin color in response to stress. The FASEB Journal, 21(4), 976-994. doi: 10.1096/fj.06-6649rev.


Dang, T. T., Bowyer, M. C., Van Altena, I. A., & Scarlett, C. J. (2018 Comparison of chemical profile and antioxidant properties of the brown algae. International Journal of Food Science & Technology, 53(1), 174-181. doi: 10.1111/ijfs.13571.

Ferreres, F., Lopes, G., Gil-Izquierdo, A., Andrade, P. B., Sousa, C., Mouga, T., & Valentão, P. (2012 Phlorotannin extracts from fucales characterized by HPLC-DAD-ESI-MSn: approaches to hyaluronidase inhibitory capacity and antioxidant properties. Marine Drugs, 10(12), 2766-2781. doi: 10.3390/md10122766.



Floegel, A., Kim, D. O., Chung, S. J., Koo, S. I., & Chun, O. K. (2011 Comparison of ABTS/DPPH assays to measure antioxidant capacity in popular antioxidant-rich US foods. Journal of Food Composition and Analysis, 24(7), 1043-1048. doi: 10.1016/j.jfca.2011.01.008.

Folin, O., & Denis, W. (1912). On phosphotungstic-phosphomolybdic compounds as color reagents. Journal of Biological Chemistry, 12(2), 239-243.

Generalić Mekinić, I., Skroza, D., Šimat, V., Hamed, I., Čagalj, M., & Popović Perković, Z. (2019 Phenolic content of brown algae (Pheophyceae) species: Extraction, identification, and quantification. Biomolecules, 9(6), 244.doi: 10.3390/biom9060244.



Green, L. C., Wagner, D. A., Glogowski, J., Skipper, P. L., Wishnok, J. S., & Tannenbaum, S. R. (1982 Analysis of nitrate, nitrite, and [15N] nitrate in biological fluids. Analytical biochemistry, 126(1), 131-138. doi: 10.1016/0003-2697(82)90118-X.


Halliwell, B., & Gutteridge, J. M. (2015). Free radicals in biology and medicine. Oxford University Press, New York, USA. pp. 331-332. doi: 10.1093/acprof:oso/9780198717478.001.0001.
Jimenez-Escrig, A., & Cambrodón, G. (1999). Nutritional evaluation and physiological effects of edible seaweeds. Archivos Latinoamericanos de Nutricion, 49(2), 114-120.

Ebanks, J. P., Wickett, R. R., & Boissy, R. E. (2009 Mechanisms regulating skin pigmentation: the rise and fall of complexion coloration. International Journal of Molecular Sciences, 10(9), 4066-4087. doi: 10.3390/ijms10094066.



Kang, S. W., Kim, E. J., Jung, Y. R., & Ko, H. J. (2018 The AntiOxidant and Whitening Activities of Seaweeds Mixture Fermentation Extracts. Journal of the Society of Cosmetic Scientists of Korea, 44(3), 327-334. doi: 10.15230/SCSK.2018.44.3.327.
Karmakar, I., Dolai, N., Saha, P., Sarkar, N., Bala, A., & Haldar, P. K. (2011). Scavenging activity of Curcuma caesia rhizome against reactive oxygen and nitrogen species. Oriental Pharmacy and Experimental Medicine, 11(4), 221-228.

Kim, B. M., Jun, J. Y., Park, Y. B., & Jeong, I. H. (2006 Antioxidative Activity of Methanolic Extracts from Seaweeds. Journal of the Korean Society of Food Science and Nutrition, 35(8), 1097-1101. doi: 10.3746/jkfn.2006.35.8.1097.

Kim, D. W., Kim, M. J., Shin, T. S., Kim, S. J., & Jung, B. M. (2008). Application of Hydrogen Peroxide on the Bacterial Control of Seaweed, Capsosiphon fulvescens (Mesaengi). Korean Journal of Food Preservation, 15(2), 169-173.
Kim, J. A., & Lee, J. M. (2004 The Change of Biologically Functional Compounds and Antioxidant Activities in Hizikia Fusiformis with Drying Methods. Journal of the Korean Society of Dietary Culture, 19(2), 200-209. doi: 10.3746/jkfn.2006.35.8.1097.
Kumari, P., Reddy, C. R. K., & Jha, B. (2011 Comparative evaluation and selection of a method for lipid and fatty acid extraction from macroalgae. Analytical Biochemistry, 415(2), 134-144. doi:10.1016/j.ab.2011.04.010.


Kwak, C. S., Kim, S. A., & Lee, M. S. (2005 The Correlation of Antioxidative Effects of 5 Korean Common Edible Seaweeds and Total Polyphenol Content. Journal of the Korean Society of Food Science and Nutrition, 34(8), 1143-1150. doi: 10.3746/jkfn.2005.34.8.1143.

Lakhanpal, P., & Rai, D. K. (2007). Quercetin: a versatile flavonoid. Internet Journal of Medical Update, 2(2), 22-37.

Lee, C. H., Park, Y. N., & Lee, S. G. (2020 Analysis and comparison of bioactive compounds and total antioxidant capabilities of Korean brown algae. Korean Journal of Food Science and Technology, 52(1), 54-59. doi: 10.9721/KJFST.2020.52.1.54.
Lee, S. H., & Lee, M. S. (2017 The research on antioxidative effect of Sasa quelpaertensis extractum and assessment of cytotoxicity. Journal of the Korea Academia-Industrial Cooperation Society, 18(3), 687-693. doi: 10.5762/KAIS.2017.18.3.687.
Lee, S. Y., Ahn, J. W., Hwang, H. J., & Lee, S. B. (2011 Seaweed Biomass Resources in Korea. KSBB Journal, 26(4), 267-276. doi: 10.7841/ksbbj.2011.26.4.267.

Moon, Y. S., Lee, M. H., & Kang, S. M. (2019). Antioxidant Activity of Red Ginseng Ingested Urine as a Cosmetic Material. Journal of The Korean Society of Cosmetology, 25(2), 436-445.
Park, J. H., Lee, M. H., & Kang, S. M. (2019). The Antioxidant and Skin Improvment Effect of Salix gracilistyla Extract. Journal of The Korean Society of Cosmetology, 25(3), 600-608.
Park, S. N., & Lee, O. H. (2020 The Antioxidation Effect of Mutimo cylindricus Extract and Its Influence on Cell Bioactivity. Journal of Convergence for Information Technology, 10(11), 279-287. doi: 10.22156/CS4SMB.2020.10.11.279.
Poljšak, B., & Dahmane, R. (2012 Free radicals and extrinsic skin aging. Dermatology Research and Practice, 2012:1-4. doi: 10.1155/2012/135206.

Poljšak, B., Dahmane, R. G., & Godić, A. (2012 Intrinsic skin aging: the role of oxidative stress. Acta Dermatovenerol Alp Pannonica Adriat, 21(2), 33-36. doi: 10.2478/v10162-012-0012-5.

Proestos, C., & Varzakas, T. (2017 Aromatic plants: Antioxidant capacity and polyphenol characterisation. Foods, 6(4), 28.doi: 10.3390/foods6040028.



Re, R., Pellegrini, N., Proteggente, A., Pannala, A., Yang, M., & Rice-Evans, C. (1999 Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine, 26(9-10), 1231-1237. doi: 10.1016/S0891-5849(98)00315-3.


Scalzo, J., Politi, A., Pellegrini, N., Mezzetti, B., & Battino, M. (2005 Plant genotype affects total antioxidant capacity and phenolic contents in fruit. Nutrition, 21(2), 207-213. doi: 10.1016/j.nut.2004.03.025.


- TOOLS
-
METRICS

-
- 3 Crossref
- 0 Scopus
- 3,449 View
- 77 Download
- Related articles
-
Antioxidant and Whitening effect of Dictyopteris spp. Extract2021 June;27(3)
The Antioxidation Effect of Gracilaria spp. extract2021 June;27(3)
The Antioxidant Activity of Abelmoschus manihot jinhuakui Extracts2021 February;27(1)
The Bioactive Effects of Germinated Brown Rice Extract by Media Type2020 February;26(1)
The Antioxidant and Skin Improvment Effect of Salix gracilistyla Extract2019 June;25(3)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print