Leuconostoc mesenteroides KD20로 발효된 가지추출물의 항산화 및 항염증 효과
Antioxidant and Anti-inflammatory Effects of Fermented Eggplant Fruit Extracts with Leuconostoc mesenteroides KD20
Article information
Trans Abstract
We isolated Leuconostoc mesenteroides KD20, which has its application as a cosmetic material, while searching for useful microbes in Gangwon-do’s traditional fermented foods. Eggplant fruit extract (EG) was fermented with lactic acid bacteria L. mesenteroides. HPLC analysis results for the component analysis of EG and the fermented eggplant fruit extract (FEG) showed bio-conversion of quercetin 3-O-β-D-glucoside and rutin. To investigate skin protection effects of EG and FEG against skin damage by ultraviolet ray, we measured antioxidation and inhibitory effect of inflammation-related cytokines in keratinocytes irradiated with ultraviolet B (UVB). Biosynthesis of IL-1α, which is increased with UVB in keratinocytes, was inhibited by 24.7% and 28.3% at 100 μg/ml of EG and FEG, respectively. Biosynthesis of PGE2 in keratinocytes was inhibited by 45.7% and 52.3% at 100 μg/ml of EG and FEG, respectively, indicating a greater effect of FEG. Therefore, EG and FEG can be used as an excellent material for cosmetics with skin protection effect against ultraviolet irradiation in keratinocytes.
I. 서 론
최근 천연 발효 성분을 함유한 기능성 화장품으로 인간에게 유익한 미생물을 이용한 자연 친화적인 화장품 조성분의 연구·개발이 폭넓게 시행되고 있다. 발효는 인체에 유익한 미생물이 여러 성분들을 분해시켜 새로운 물질을 만들거나, 작게 분해시켜 피부 또는 체내에 유익한 기능을 나타내거나 흡수가 용이하도록 돕는 것을 의미하며, 이를 ‘발효과학’이라고 한다(Kim et al., 2004; Ames et al., 1993).
천연 발효 성분은 유산균, 효모 등과 같은 미생물로 발효하여 유효 성분의 함량을 증가시켜 인체에 안전하게 적용할 수 있는 화장품 소재이다. 특히 유산균으로 알려진 젖산균(Lactococcus, Lactobacillus, Leuconostoc 속)은 배당체 형태로 존재하는 물질들을 당이 없는 비배당체 구조로 발효과정을 통해 바이오 전환을 시킬 수 있다는 것이 발표된 바 있다(Kim et al., 2018; Kim et al., 2017; Qi et al., 2006). 일반적으로 비배당체 구조의 물질들은 배당체 구조에 비해 항산화 활성 등이 큰 것으로 알려져 있다(Kim et al., 2019).
우리 인체 내의 free radical은 유용한 산화물로 박테리아를 죽이지만 과량으로 존재하게 되면 세포막을 산화시키고 세포를 파괴한다(Ames et al., 1993). 특히 자외선에 의해 증가한 활성산소종(ROS, reactive oxygen species)은 광노화, 홍반, sunburn, 피부암(skin cancer) 등의 질병을 일으킨다(Na et al., 2006).
ROS는 초과산화물(superoxide anion, O2-), 과산화수소(hydrogen peroxide, H2O2), hydroxy radical 등을 포함하며, 호흡 및 대사과정을 통해 지속적으로 생성된다(Park, 2016). 우리의 인체는 superoxide dismutase (SOD), glutathione peroxidase (Gpxes), catalase와 같은 효소를 이용하여 ROS에 의한 손상을 막는다. 그러나 자외선에 의해 활성산소종(ROS, reactive oxygen species)은 과량으로 발생하여 생체내의 항산화적 방어능력을 초과하게 되고, 산화적 스트레스의 발생으로 과량의 ROS는 세포막 및 단백질, DNA 등과 반응하여 세포나 조직 등에 손상을 유발시키며, 이는 광노화, 암, 각종 염증질환, 파킨슨병 등의 발생을 촉진하는 것으로 알려져 있다(Na et al., 2006). Prostaglandin E2 (PGE2), Interleukin (IL), Free radical, Nitric oxide, Cytokine, Chemokine 등 다양한 염증 반응으로 노화를 촉진시키고, 여러 가지의 질병 및 암발생과정에 밀접한 연관이 있으며(Lee, 2014), 이를 조절함으로써 항염, 항산화 등의 효과가 있어 여러 가지 질병을 예방할 수 있다.
가지(eggplant)는 식품 뿐 아니라 한방에서는 피부를 맑게하고, 진정효과가 있어 피부의 열을 내려주는 효능이 있다고 알려져있고, 민간요법으로는 티눈, 사마귀, 주근깨 등을 없애는 효과가 있다고 하여 한의약에서 꾸준히 사용되어왔다. 가지(eggplant)과에 속하는 Solanum melongena L.는 Eggplant, Guinea squash, Aubergine라고 하며, 한자로는 가(茄), 가자(茄子), 낙소(酪酥), 곤륜과(崑崙瓜), 초별갑(草鱉甲) 등으로 불리운다. 가지(eggplant)는 전통적으로 한약제로 사용되었으며, 천식, 습진, 피부궤양, 항균작용, 거담작용, 치통, 동상, 배뇨장애 등의 치료 효과가 보고되어 있다(Park, 2014). 민간요법으로는 생가지를 썰어서 피부에 문지르면 기미, 주근깨, 땀띠 등을 완화시키고, 사마귀가 생겼을 때 생가지 꼭지로 문지르면 없앨 수 있다고 알려져 있으며, 가지(eggplant)를 생식하게 되면 버섯중독을 해독시킬 수 있다고 한다(Na et al., 2006).
가지(eggplant)의 화학성분은 choline, solanine, stachydrine, trigonelline 등 많은 종류의 alkaloid를 함유하고 있으며(Park, 2013), 티아민(비타민 B1), 리보플라빈(비타민 B2), 니코틴산(비타민 B3), 적은 양의 카로틴이 함유되어 있다. Solanine의 함량은 씨에 1.2~1.5%로 가장 높게 나타났으며, 과피에는 nasunin, delphiidin-3-monoglucoside, delphindin-3, shis-oni-5-n, 5-diglucoside 등을 함유하고 있다. Solasonine과 solamarging은 항암작용에 효과가 있고, 열매와 잎은 혈중 콜레스테롤을 낮춰주고, 가지껍질의 안토시아닌 색소는 free radical 소거 활성 효과가 강하게 나타났다(Park, 2013).
이러한 목적으로 이용할 수 있는 물질을 개발하기 위해 기존 물질의 구조를 변형시킬 수 있는 방법으로 가지(eggplant)에 발효과학을 적용하게 되었다.
따라서 본 연구는 강원도의 전통발효식품에서 동정·분리하여 획득한 균주 중 화장품소재로 활용이 가능한 Leuconostoc mesenteroides를 활용하여 가지추출물을 발효함으로써 발효 전·후의 항산화 및 항염증 효능을 알아보고 화장품에 적용 가능한 소개를 개발하고자 하였다.
II. 재료 및 방법
1. 재료 및 시약
본 실험에 사용된 가지(Eggplant, Korea)는 경동시장에서 구입하여 세절한 후 완전히 건조하여 분쇄한 것을 사용하였다. 강원도의 전동발효식품인 가자미식해는 강릉원주대학교로부터 공급받아 사용하였다.
세포배양에 사용된 dulbecco’s modified eagle medium (DMEM), fetal bovine serum (FBS), penicillin/streptomycin, 0.4% trypan blue stain은 Hyclone (Logan, UT, USA)에서 구입하였고, Antibiotics (Gibco, USA), haemacytometer (Marienfeld, Germany), 1,1-diphenyl-2-picryl hydrazyl, 2,2'-azinobis (3-ethylbenzothiazoline-6-sulfonic acid), Quercetin 3-O-β-D-glucoside, rutin, Glucose, NaHCO3, MTT, dimethyl sulfoxide (DMSO)는 Sigma Chemical Co. (St. Louis, MO, USA)에서 구입하여 사용하였다. 항산화, 항염증 및 피부장벽 측정에 사용된 시약 PGE2 enzyme linked immunosorbent assay (ELISA) kit는 R&D Systems (Minneapolis, MN, USA)에서, RIPA buffer, HaltTM Protease Inhibitor Cocktail Kit, BSA kit는 Thermo scientific (Rockford, IL, USA)에서 구입하였고, antibody중 primary antibody (antihuman IL-1α) in PBS-T, filaggrin antibody와 secondary antibody (Goat anti-rabbit IgG conjugated with peroxidase)는 Santa cruz Biotechnology (Santa cruz, CA, USA)에서 구입하였다. 그 외의 시약은 특급 및 일급시약을 구입하여 사용하였다.
2. 세포배양
사람의 각질형성세포주(human keratinocyte cell line) HaCaT keratinocytes는 Cell lines sevice (Eppelheim, Germany)로부터 분양받아 사용하였고, 세포는 10% FBS와 1% penicillin (100 units/ml)/streptomycin (100 g/ml)을 첨가한 DMEM 배지를 사용하여, 37°C, 5% CO2 incubator에서 배양하였으며, 2-3일 간격으로 계대 배양하였다.
3. 균의 분리 및 동정
강원도 전통발효식품인 가자미식혜를 멸균 증류수에 현탁하였고, 시료 30 g에 270 ml의 멸균 생리식염수를 stomacher bag에 담아 stomacher를 이용하여 4분간(260 rpm) 균질화하였으며, 그 상층액을 10-4~10-6으로 희석한 후 미리 준비한 1%(w/v) CaCO3를 함유하는 MRS agar (Difco Laboratories, Ml, USA) 배지에 도말 하여 30°C incubator에서 24시간 배양하여 선발하였다. 선발된 균주는 4회의 계대 배양 후 형성된 단일 col ony를 순수 분리하였고(Park & Kim, 2009), 순수 분리한 colony의 DNA를 추출하여 DNA 분석기관인 ㈜마크로젠에 의뢰하여 16S rRNA 분석을 실시하였다. BLAST program을 사용하여 전통 발효식품에서 분리한 균주는 L. mesenteroides와 99% 이상 상동성을 갖는 균주임을 확인하여 L. mesenteroides KD20이라 명명하였다.
4. 추출 및 발효 조건
가지 열매(100 g)의 껍질을 분리 후 세절하여 완전히 건조 후 분쇄하여 열수추출(80°C, 4시간) 하였다. 열수추출로 얻은 가지 추출물(Eggplant fruit extract, EG)을 기질로 하여 L. mesenteroides 균주를 접종하여 30°C, 120 rpm에 48시간 배양한 후 가지발효 추출물(Fermented Eggplant fruit extract, FEG)을 얻었다. 이를 감압 농축시킨 후 급속냉동기(DF 9010, Korea)를 이용하여 –80°C에서 급속냉동한 후, 동결건조기(FD5508, Korea)로 –45°C에서 동결건조하여 분쇄기(DA282-2, Korea)로 갈아서 체(ISO mesh 200 m)로 걸러서 그 분말을 실험에 사용하였다.
5. HPLC 분석
가지추출물(EG)과 발효된 가지추출물(FEG)의 성분변화를 확인하기 위해 HPLC 분석을 실시하였고, HPLC 분석은 Alliance Waters 2695 (Waters Co., Milford, MA, USA) 시스템을 사용하였다. 컬럼은 Capcel l PAK C18 column (250 × 4.6 mm I.D., OSAKA SODA Co., Japan)을 사용하여 0.6 ml/min의 유속으로 360 nm에서 검출하였으며, 컬럼온도는 35°C로 설정되었다. 또한 이동상은 용매 A (MeOH)와 용매 B (1% Formic acid in D.W)의 gradient 조건을 사용하였다. 0~15분 동안 A를 5~10%까지 진행하였고, 15~50분 동안 A를 10~50%로 진행되었다. 모든 추출물은 0.45 m 필터를 통해 여과하여 HPLC에 주입하였다. 생물전환 후 지표성분인 Quercetin 3-O-β-D-glucoside와 rutin 등은 Dimethyl sulfoxide (DMSO)에 녹여 표준용액으로 조제하였다(Fig. 1).
6. 항산화 효과 측정
1) DPPH를 이용한 자유라디칼 소거 활성실험
DPPH (1,1-diphenyl-2-picrylhydrazyl) radical 소거 활성 실험은 Blois MS의 방법을 변형하여 시행하였다. 시료 0.5 ml에 60 μM DPPH (in EtOH) 3 ml를 넣고 혼합한 후 암실에서 15 min 간 반응한 다음 분광광도계를 사용하여 517 nm에서 흡광도를 측정하였다. 전자공여능은 인체 내에서 활성 라디칼에 의한 활성산소 작용의 척도로 사용되는 실험으로 소거율을 백분율로 환산하여 결과를 나타내었다.
2) ABTS 측정
ABTS 라디칼 소거능은 Nicoletta 등(Nicoletta et al., 1999)의 방법에 따라 측정하였다. 7 mM ABTS 5 ml와 140 mM, K2S2O₈ 88 µl를 섞어 암실에 14~16시간 반응시켰다. 이를 absolute ethanol과 1:88 비율로 섞어 734 nm에서 흡광도 값이 0.7±0.002가 되도록 조절한 ABTS solution을 사용하였다(Shin et al., 2012). 시료용액 150 µl와 ABTS solution 3 ml를 혼합하여 30초간 vortex 후 2~3 min 간 상온에서 반응시키고 734 nm에서 흡광도를 측정하였다.
7. 세포 독성 측정
세포에 미치는 독성을 확인하기 위하여 MTT assay를 진행하였다. 먼저 96 well plate에는 5 × 104 cell/well 되도록 분주 후 24시간 뒤에 각 농도에 맞도록 DMSO에 녹인 sample을 첨가하였다(Kim et al., 2015). 24시간 뒤에 배지를 제거한 후 MTT 시약(in PBS 2.5 mg/ml) well에 40 µl씩 가하고 incubator에 4h 반응 후 다시 상층액을 제거하였다. DMSO를 100 µl씩 분주하여 완전히 녹인 후 분광광도계를 이용하여 흡광도 540 nm에서 측정하였다.
8. 자외선에 의해 유도된 염증관련 사이토카인(IL-1α)의 발현 저해 효과 측정
각질형성세포(1×105 cells/ml)를 UVB 10 mJ/cm2 세기로 조사한 후 serum free DMEM 배지를 500 l 첨가하고 가지추출물과 발효한 가지추출물을 농도별로 첨가하였다. 24시간 동안 배양 후 배양 상등액을 wel l pl ate에 4°C에서 코팅하였다. 3% BSA로 37°C 2시간 동안 blocking하고 primary antibody (antihuman IL-1α) in PBS-T를 첨가하여 37°C 90분 동안 반응시켰다(Lee et al., 2018). 세척 후 secondary antibody (Goat antirabbit IgG conjugated with peroxidase)를 첨가하고 90분 동안 37°C 반응시킨 후 o-phenylene diamine이 함유된 기질용액을 첨가하여 발색시켜 490 nm에서 흡광도를 측정하였다(Shin et al., 2012).
9. 자외선 조사 후 PGE2 생성 저해효과 측정
각질형성세포(HaCaT keratinocytes)를 well plate에 각각 5×104 cells/ml씩 넣고 24시간 동안 부착하였다. 그런 다음 부착된 세포를 인산완충용액(phosphate buffered saline, PBS) 으로 2회 세척 후 500 l의 인산완충용액(PBS)을 첨가하였다. 이 각 질형성세포에 UVB 램프(Model: F15T8, UVB15W, Sankyo Dennki, Japan)를 이용하여 UVB 를 10 mJ/cm2를 조사한 후, 배양배지로 교환하여 시료처리 하였다(Na et al., 2006). 24시간 후 상층액을 회수하여 상층액에 유리된 PGE2의 양을 효소면역 분석법(Enzyme-linked immunoassay, ELISA)으로 정량하였다(Park et al., 2013).
10. 통계처리
모든 실험의 결과값은 3번의 독립적인 실험을 통한 평균(M; Mean)과 표준편차(SD; standard deviation)로 나타내었고, SPSS 20.0 프로그램(SPSS, Inc., Chicago, IL, USA)을 이용하였다. 대조군과 실험군 두 집단 간 차이를 검정하기 위해 사용된 1-way analysis of variance (ANOVA)와 함께 튜키-크래머(TukeyKramer) 방법을 통한 사후검정 결과를 그래프에 요약하였다. ANOVA는 유의확률(p-value) 0.05 미만일 때 통계적으로 의미있는 결과로 판단하였다.
III. 결과 및 고찰
1. HPLC 분석결과
발효에 의한 가지추출물의 성분변화를 확인하기 위해 HPLC 분석을 실시한 결과, Quercetin 3-O-β-D-glucoside (RT. 40.4 min), rutin (RT, 39.6 min), quercetin (RT, 50.4 min)이 생성되는 것을 확인할 수 있었다. Fig. 2에서 나타난 바와 같이 quercetin의 피크는 48시간 발효하는 동안 유의하게 증가하였다. 또한 Quercetin 3-O-β-D-glucoside과 rutin 등의 배당체로 나타난 두 개의 피크는 발효 후 전환율 약 40% 이상인 것을 확인하였다(Table 1). 가지추출물에 존재하는 chlorgenic acid (RT. 28.9 min) 등은 발효과정에서 유의적인 차이를 나타내지는 않았으나, 생물전환에 의해 생성된 quercetin의 함량은 0.08%로 나타났다.
Hwang et al.(2006)은 백삼의 ethyl acetate 분획물이 피부 미백 소재의 기능을 가지는 것으로 보고하였고, 이에 함유되어 있는 phenolic compound인 cinnamic acid 및 quercetin 등에서 tyrosinase 저해활성과 세포내 melanin 함량을 저해시키는 효능을 가지고 있다고 보고하였다(Hwang et al., 2006). Jo et al. (2012)은 가지외피에 많이 존재하고 있는 페놀성 화합물인 chlorgenic acid는 자유라디칼을 소거하는 성분으로 페놀성 화합물인 안토시아닌, 플라보노이드, 페놀산 등 총 페놀성 화합물 함량은 1,1-diphenyl-2-picrylhydrazyl(DPPH) radical 소거활성과 같은 항산화 활성에 중요한 인자로 작용한다고 보고하였다(Jo et al., 2012).
따라서 본 연구의 가지발효추출물에 존재하는 chlorgenic acid는 천연물질을 이용한 항산화제와 미백제 등에 관한 연구에 따라 vitamin E, phenolic acid, carotenoid, flavonoids, 등 주요 페놀성 화합물로서 chlorogenic acid를 포함한 천연 화장료로서 피부의 항산화 작용과 미백 작용에 활용 가능성이 기대된다.
2. 항산화 효과
1) DPPH radical 소거능 활성
DPPH radical은 보랏빛을 띠는 비교적 안정적인 라디칼로 항산화 물질과 반응하면 proton-radical scavenger에 의해 노란빛으로 탈색되는 특징이 있으며(Park & Park, 2016), 흡광도의 차이는 색변화에 의해 517 nm 부근에서 최대가 된다. 항산화 활성을 측정하는데 있어서 비교적 간단한 방법으로 측정할 수 있으므로 많이 이용되고 있다.
가지추출물과 발효된 가지추출물의 항산화 효능을 측정하기 위한 방법으로 DPPH radical 소거능을 측정하였으며(Yoon et al., 2017), Fig. 3에 나타내었다. 가지추출물과 발효된 가지추출물 모두 농도 의존적인 항산화 효과가 나타났다. 5, 10, 25, 50, 100, 500, 1000 g/ml 농도에서 발효된 가지추출물의 효과가 가지추출물보다 더 높게 나타났다. 특히 1000 g/ml 농도에서는 대조군인 L-ascorbic acid와 비교하였을 때에도 비교적 높은 효과를 보여 효과적인 항산화 기능 첨가물질로서 가능성을 확인하였다.
2) ABTS 활성
ABTS cation radical은 짙은 청록색을 띠는 라디칼로 항산화 물질과 반응함에 따라 연한 녹색으로 탈색되는 특징이 있다(Natella, et al., 2014). Hydrogen-donating antioxidant와 chainbreaking antioxidant 모두를 측정할 수 있는 방법으로 알려져 있으며(Yoon et al., 2017), DPPH 실험법과 마찬가지로 비교적 손쉬운 실험방법으로 인해 일반적으로 많이 사용하고 있는 항산화활성 측정 방법 중 하나이다. 가지추출물과 발효된 가지추출물 모두 농도 의존적인 항산화 효과가 나타났다(Fig. 4). 10, 25, 50, 100, 500, 1000 µg/ml 농도에서 발효된 가지추출물의 효과가 가지추출물보다 더 높게 나타났다. 특히 500, 1000 µg/ml 농도에서는 대조군인 L-ascorbic acid와 비교하였을 때에도 비교적 높은 효과를 보여 효과적인 항산화 기능 첨가물질로서 가능성을 확인하였다.
3. 세포독성
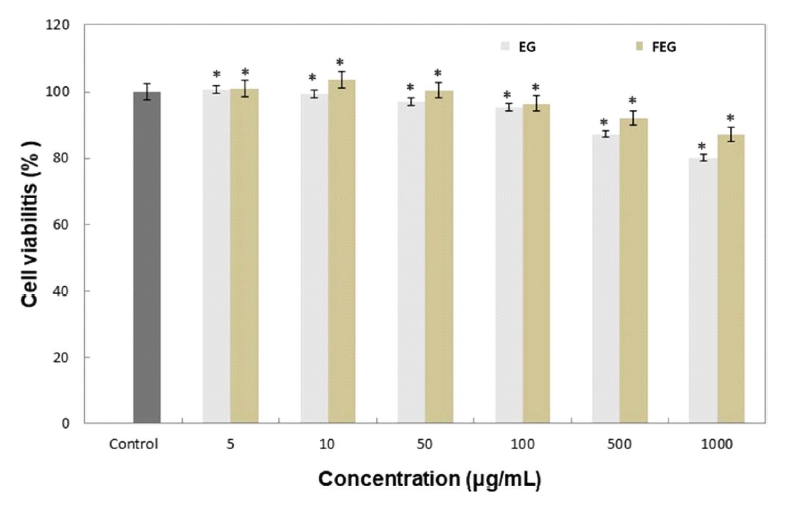
피부 각질형성 세포는 외부 환경에 의해 다양한 반응에 관여하며 염증 반응 시 NO와 염증성 cytokine이 생성 및 분비되며 염증반응에 관여하는 주요한 세포이다. 모든 시료의 세포 생존율을 확인하기 위해 MTT assay를 진행하였다(Fig. 5). 가지추출물과 발효된 가지추출물을 5, 10, 50, 100, 500, 1000 g/ml 농도로 처리한 결과, 발효된 가지추출물의 세포 생존율이 가지추출물의 세포 생존율이 유사하거나 더 높게 나타났다. 100 g/ml 아래의 농도에서 95% 이상의 세포 생존율을 나타냈으며, 500 g/ml 에서는 90%의 세포생존율을 나타냈다. 따라서 항염증 관련 세포 실험의 최고 농도를 100 g/ml 농도를 이후로 설정하였다.
4. 자외선에 의해 유도된 염증관련 사이토카인(IL-1α)의 발현 저해 효과
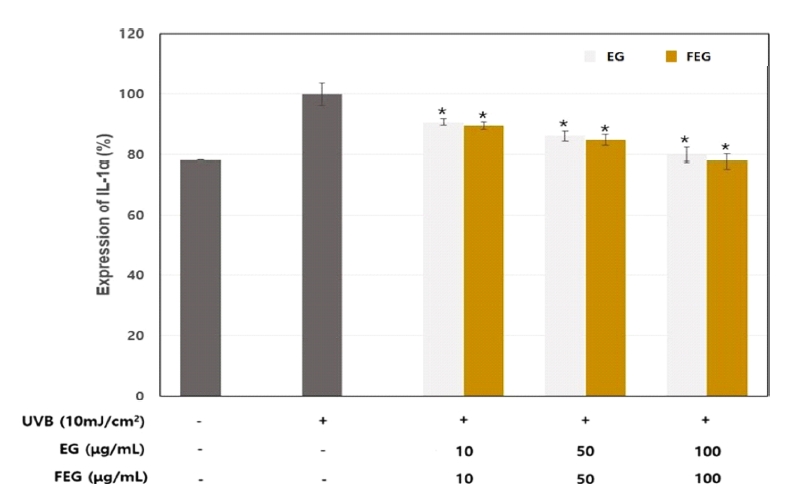
피부 이상 반응을 유발인자에는 화학물질, 세정제, 자외선 등 여러가지가 있으며, 이에 대한 피부보호 작용을 평가하기 위해 자외선에 의해 유도된 염증관련 사이토카인인 IL-1α의 생성량을 측정한 결과 UVB에 의해 유발된 염증관련 사이토카인인 IL-1α의 생성량은 증가하였으며 가지추출물 100 μg/ml에 의해 24.7% 정도 감소되는 것으로 나타났으며, 반면 발효된 가지추출물은 100 μg/ml에 의해 28.3% 감소되는 것으로 나타났다(Fig. 6).
5. 자외선 조사 후 PGE2 생성 저해효과
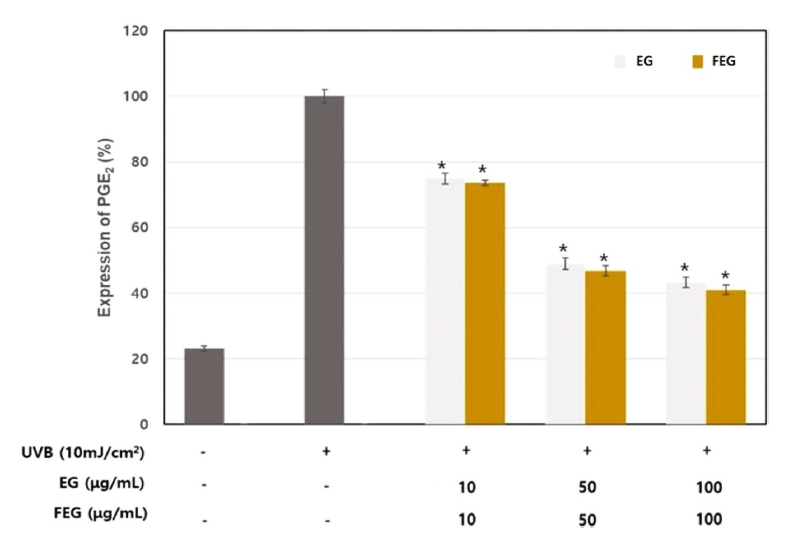
UV나 ROS에 의해 발현되는 염증성 사이토카인인 PGE2의 양을 경쟁적 효소 면역분석법으로 정량하였다(Na et al., 2006). 자외선(UVB 10 mJ/cm2) 조사량에 의해 79.2 ng/ml 정도로 증가하였고, 생리작용에 의한 세포 자체의 기본 PGE2의 농도는 17.9 ng/ml 였다. 가지추출물과 발효된 가지추출물을 농도별로 처리한 결과, 자외선에 의해 높아졌던 PGE2 생성량이 농도 의존적으로 다시 감소하였으며, 소거효과를 분석한 결과 가지추출물의 경우 100 μg/ml의 농도에서 45.7%를 보였다. 발효된 가지추출물은 100 μg/ml의 농도에서 52.3%의 우수한 PGE2 생성 억제 효과를 나타내었다(Fig. 7). 가지의 주요성분으로 알려진 anthocyanin과 nasunin의 항산화 작용과 페놀성 화합물인 chlorogenic acid, 바이플라보놀 글리코시드계(biflavonol glycoside), 솔라노플라본(solanoflavone)의 항염 작용 등이 알려져 있다(Kim et al., 2014). 따라서, 가지추출물과 발효된 가지 추출물은 이러한 성분을 함유하고 있으면서 발효과정에서 배당체가 아글리콘으로 전환하여 우수한 PGE2 발현억제 효과를 갖는 것으로 나타나 발효된 가지 추출물은 향후 고기능성 제품에 적용하여 자극완화 효과와 안전하고 다양한 천연화장품 개발에 적용할 수 있을 것이라 사료된다.
IV. 결 론
본 연구에서는 강원도의 전통발효식품에서 분리한 L. mesenteroides를 활용하여 가지 추출물의 플라보노이드 배당체를 비배당체로 생물학적 전환하는 공정을 개발하고, 항산화 및 항염증 효능을 갖는 소재를 연구하고자 하였다. 이 연구를 통해 발효과정을 거쳐 생물전환에 의해 rutin과 Quercetin 3-o-glucoside에서 quercetin으로 전환되는 것을 확인하였다. 기타 chlorogenic acid 등의 다양한 성분의 존재를 확인하였고, 발효 후 일부의 지표 성분이 증가하는 것을 확인하였다.
항산화 효과를 알아보기 위해 DPPH, ABTS의 실험을 진행한 결과, 기존의 항산화제로 널리 사용되고 있는 L-ascorbic acid와 비교해 보았을 때 발효된 가지추출물은 효과적인 항산화 기능성 첨가 물질로서의 가능성을 확인할 수 있었다. 또한 MTT assay에서는 발효된 가지추출물의 세포 생존율이 가지추출물의 세포 생존율과 유사한 결과를 보여 세포 독성이 없음을 확인하였다. 항염증 효과를 알아보기 위해 각질형성세포에서 UVB에 의해 생합성이 증가되는 IL-1α 및 PGE2의 생합성 억제 효과는 가지추출물은 100 μg/ml에서 24.7%, 45.7%를 저해하였으며, 발효한 가지추출물은 100 μg/ml에서 28.3%, 52.3%를 저해하여 우수한 효과를 나타내었다. 따라서 발효된 가지추출물은 항염증 및 피부진정소재로의 활용가치가 있는 소재라는 것을 확인하였다. 특히, 발효전 보다 발효 후에 항산화, 세포 생존율, 항염증 효과가 증진됨을 확인할 수 있었다. 이와 같은 결과에 따르면 L. mesenteroides을 사용하여 발효된 가지추출물은 세포독성이 없으면서도 항산화, 항염증 효과를 기대할 수 있어 기능성 화장품을 위한 효과적인 원료로 사용 가능할 것으로 사료된다.