타피오카와 겉보리 혼합주정박 추출물의 미백효과, 항산화 및 주름개선 효과
Study for Whitening Effect, Antioxidant and Anti-wrinkle Activity of Tapioca-unhulled Barley Dried Distiller's Grains with Solubles
Article information
Trans Abstract
This study intends to present the value of use as an eco-friendly, bioactive functional material by utilizing the undervalued tapiocaunhulled barley dried distiller's grains with solubles (TBDDGS). The physiological activity of TBDDGS presented through whitening activity, antioxidant activity, and anti-wrinkle effect. As a result of measuring the mushroom tyrosinase inhibitory activity in the hot water extracts of TBDDGS, the extracts showed 1.21% at 20 mg/mL concentration, 7.39% at 50 mg/mL concentration, and 25.78% at 100 mg/mL concentration, depending on the concentration of the extracts. The radical scavenging ability of DPPH was 28.7% at 10 mg/mL concentration, 38.0% at 20 mg/mL concentration, 60.9% at 50 mg/mL concentration, and 80.1% at 100 mg/mL concentration. The collagenase inhibitory activity of the extracts was 92.8% at a 6 mg/mL concentration. Elastase inhibitory activity was 97.8% at 100 mg/mL concentration. From the above results, the collagenase inhibitory activity of the extracts was 92.8% at a 6 mg/mL concentration. The elastase inhibitory activity was 97.8% at 100 mg/mL concentration. Although TBDDGS in this study has lower physiological activity compared to the control group, it was considered to have industrial value as a functional cosmetic raw material in consideration of the advantages of stable raw material supply and price competitiveness as an eco-friendly cosmetic raw material.
I. 서 론
최근 소득 및 소비 수준의 변화, 시대를 반영하는 가치관에 따라 웰빙 등 사회적 트렌드에 맞춰 화장품 시장이 확대되어 가고 있다(Kwon, 2018). 화장품 제조업은 기능성 식품, 생명공학 관련 사업 및 농수축산업과 밀접하게 연계되어 친환경 생리활성 소재를 이용한 기능성 화장품제조에 관심이 증가하고 있다. 특히 공해로 인한 피부의 건조, 산소결핍에 의한 피부의 생기와 탄력감소, 표피층 재생속도 저하, 피부조직 내 주요 항산화물질 또는 그 활성 감소로 인하 피부의 노화가 촉진되면서 이를 방지할 수 있는 기능성 소재개발이 요구되고 있다(Park & Kim, 2019).
주정박은 한 종류의 곡물 또는 혼합곡물을 효모로 에탄올 발효시킨 후 증류(주정제조)하고 남은 부산물을 말하는 것(Risolia et al., 2016)으로 주정박 제조공정에 따라 주정추출 후 획득된 습고형주정박(Wet distiller's grains, WDG), 이때 분리된 농축액을 농축잔액(Condensed distiller's solubles, CDS), 습고형주정박을 건조한 것을 건고형주정박(Dried distiller's grains, DDG), 건조된 DDG를 다시 CDS와 혼합하여 건조한 것을 주정박(Dried distiller's grains with solubles, DDSG)이라 한다(Kellems et al., 1991). 주정제조에 사용하는 원료는 크게 전분질 원료와 당질 원료로 구분되며, 곡류(옥수수, 쌀, 보리쌀), 서류(타피오카, 고구마, 감자)등을 주된 원료로 하여 발효공정 후 남은 잔여물을 사용한 것을 옥수수 주정박, 보리 주정박, 타피오카 주정박이라고 부른다(Kim, 2014).
타피오카(Manigot esculenta Crantz)는 카사바(cassava)의 뿌리에서 추출한 전분으로 카사바 전분, 마니오카 전분, 만죠카(mandioca), 매니핫(manihot) 이라고도 불린다. 카사바는 열량이 높고 토양과 기후의 영향을 받지 않아 생산성이 높으면서 생산비는 낮아 수요가 증가하고 있는 뿌리식물이다(Mishra & Rai, 2006; Kim et al., 2007). 타피오카는 품종과 사육조건에 차이가 있겠지만 건물량 중 조단백질이 2.1~3.6%(총질소의 60%가 아미노산), 조지방 0.3~1.4%, 가용무질소물 90%이상 (전분이 80%, 당분 20%)으로 알려져 있다(Chee, 1986). 타피오카는 동남아시아, 아프리카, 브라질 등 열대지방에서 주식으로 이용하고 있는 자원(Shon & Chin, 2012)으로 경제적이고 공급량이 안정적이여서 주정 원료 소비량의 약 80% 정도로 이용되고 있지만(Jeong et al., 2002) 타피오카 가공부산물에 관한 연구는 전무한 실정이다.
보리(Hordeum vulgare L.)는 외떡잎식물 벼목 화본과(Gramineae)의 Triticeae에 속하는 밀, 벼 ,옥수수와 더불어 4대 곡물 중의 하나로 우리 식생활에서 쌀과 더불어 중요한 작물이다. 보리의 종류는 보리가 성숙 후 껍질이 쉽게 분리되는 쌀보리와 껍질이 종실과 밀착되어 분리가 어려운 겉보리로 나뉜다. 이러한 겉보리는 주식으로 이용되기도 하고 엿기름이나 보리 차용으로 주로 소비되고 있다. 최근 들어 보리는 식이섬유, β-glucan, phytic acid 및 불포화 지방산 등 다양한 기능성 물질의 활성(Cho, 2015)으로 혈중 콜레스테롤, 혈당 저하(Lee et al., 1997) 및 대장암(Riccardi, 2008) 등에 효과가 알려지면서 건강기능성 소재로써 가능성이 제시되고 있다.
주정 생산 시 발생하는 주정박은 연간 약 55,850ton으로 추정되고 있으며, 알코올 발효 후 남은 곡물찌꺼기, 호프 그리고 효모가 주된 부산물로 당분과 단백질을 포함한 기타 영양소들을 다량 함유하고 있어서(Kim, 2014) 기능성 소재로서 잠재적인 가치가 높은 특성을 가지고 있다. 따라서 본 연구는 주정 제조시 발생한 타피오카와 겉보리 혼합주정박의 생리활성 측정하여 피부의 노화를 억제할 수 있는 친환경 소재의 생리활성 기능성 원료개발을 위한 기초자료를 제시하고자 한다.
II. 재료 및 방법
1. 실험원료
본 실험에 사용한 타피오카와 겉보리 혼합주정박(타피오카: 겉보리 5:1)은 일산실업주식회사(경남 함안) 판매되는 주정박(Tapioca-unhulled barley dried distiller's grains with solubles, TUDDSG)을제공(2020년 3월)받아실험에사용하였다. TUDDSG의 수용성 물질을 추출하기 위해 시료량 10배의 증류수를 가한 후 환류추출(80°C, 4hr)하였다. 추출물을 여과(3 μm filter paper)한 후 농축·동결건조 처리하여 시료로 사용하였다(TUDDSG 동결건조물의 수율 14.4%).
2. 실험방법
1) Tyrosinase 저해 활성
식품의약품안전처의 미백 기능성 화장품 시험법(NIFDSE, 2020)에 따라 mushroom tyrosinase 저해 활성을 측정하였다. 완충액 500 μL에 기질액 500 μL, 물 450 μL 및 검액 50 μL를 넣어 섞고, 효소액을 50 μL를 넣어 흔들어 섞어 37°C에서 10분간 반응시키고 곧 얼음 중에 5분간 방치한 다음, 완충액 500 μL, 물 950 μL 및 에탄올 50 μL를 넣어 검액과 같은 방법으로 조작하여 얻은 액을 대조액으로 하여 파장 475 nm에서 흡광도 B를 측정하였다(VICTOR X3™, PerkinElmer, US). 따로 검액 대신 에탄올 50 μL을 가지고 검액과 같은 방법으로 조작하여 얻은 액을 공시험액으로 하여 그 흡광도 A를 측정하며, 효소액 대신물 50 μL를 넣어 검액과 같은 방법으로 조작하여 얻은 액을 색보정액으로 하여 그 흡광도 C를 측정하고 다음 식에 따라 mushroom tyrosinase 저해 활성(%)을 구하였다. 양성대조군으로는 arbutin을 사용하여 그 결과를 비교하였다.
· A: 공시료액의 반응 후의 흡광도
· B: 검액에서 얻은 흡광도
· C: 색보정액에서 얻은 흡광도
2) 항산화 활성
전자공여능을 측정하여 시료의 항산화력을 측정하는 DPPH radical 소거능은 Yoshida 등의 방법(1989)에 따라 측정하였다. 96well plate에 control에는 추출물을 추출한 용매를 100 μL, 시험군 100 μL 씩 각각 넣는다. 모든 well에 100 μL씩 넣고 50 μL의 DPPH (0.5 mM 1,1-diphenyl-2-picrylhy- drazy l(DPPH)/ethanol) 용액을 가하여 혼합한다. 25°C의 실온에서 30분 동안 반응시킨 후 517 nm에서 흡광도(VICTOR X3™, PerkinElmer, US)를 측정한다. 용매만을 첨가한 대조구에 대한 추출물의 DPPH radical 소거능을 백분율로 나타내었다.
ABTS radical 소거활성은 Re et al.(1999)의 방법을 변형하여 측정하였다. 7 mM ABTS 5 mL와 140 mM potassium persulfate 88 μL를 섞은 후 상온에서 16 시간 암실보관 후 414 nm에서 흡광도 값이 1.5가 되도록 PBS로 희석하였다. 조제된 희석용액 190 μL와 시료 10 μL를 혼합한 후 상온에서 6분간 반응시킨 후 734 nm에서 흡광도(VICTOR X3™, PerkinElmer, US)를 측정하였고 대조구에 대한 라디칼 소거능을 백분율로 나타내었다.
3) Collagenase 저해활성
Collagenase 저해활성은 EnzCheck® Gelatinase/Collagenase assay kit(Invitrogen, USA)를 사용하였다. 즉 1 mg DQ collagen vial에 1.0 ml의 water를 가해 DQ collagen stock solution (1 mg/ml)을 제조했다. 10xreaction buffer 2 mL에 water 18 mL를 가해 reaction buffer를 희석했다. 다음으로 collagenase 효소 시약을 제조하였다. Working solution으로 최종 농도가 0.2 U/mL이 되도록 reaction buffer로 희석했다. 시료를 96well plate에 50 μL씩 triple로 준비한다. DQ collagen 20 μL와 sample blank에는 reaction buffer 30 μL, sample에는 working solution 30 μL를 시료에 가하고, 빛을 차단한 상태로 실온에서 1~2시간 동안 방치한 후 형광 강도 excitation wavelength 485 nm 및 emission wavelength 535 nm에서 ELISA plate reader (VICTOR X3™, PerkinElmer, US)로 측정하였다.
· a: 공시료액의 반응 후의 흡광도
· b: 시료액의 반응 후의 흡광도
· a',b': 콜라게나제 대신 완충액으로 대체하여 측정한 흡광도
Elastase 저해활성은 EnzCheck® Elastase Assay Kit(Invitrogen, USA)를 사용하였다. 1 mg DQ elastin vial에 0.5 mL의 DW를 가해 DQ elastin stock solution (1 mg/mL)을 제조했다. 10 × reaction buffer 2 mL에 DDW 18 mL를 가해 reaction buffer를 희석했다. 다음으로 elastase vial에 1 × reaction buffer를 0.5 mL 가하여 100 U/mL로 제조하였다. 효소의 working solution으로 최종 농도가 0.1~0.2 U/mL이 되도록 1 × reaction buffer로 희석했다. 시료를 96well plate에 50 μL씩 triple로 진행하였다. 시료를 넣은 후 elastase 효소 100 μL를 control과 Test sample에 처리하고 나머지 control blank와 sample blank에는 DW를 처리하였다. 잘 섞어준 뒤 DQ elastin 50 μL를 모든 well에 가하였다. 빛을 차단한 상태로 실온에서 1시간 반응 후 강도 excitation wavelength 485 nm 및 emission wavelength 535 nm에서 ELISA plate reader (VICTOR X3™, PerkinElmer, US)로 형광강도를 측정하였다.
· a: 공시료액의 반응 후의 흡광도
· b: 시료액의 반응 후의 흡광도
· a',b': 엘라스타제 대신 완충액으로 대체하여 측정한 흡광도
3. 통계학적 분석
자료의 분석은 Minitab 17(Mini-Tab 17, Minitab Inc., State College, PA, USA)을 사용하였다. 모든 실험은 3회 반복실험을 통하여 평균값으로 나타내었으며 대조군에 대한 통계적 유의성은 p<0.05 수준에서 유의성을 검증하였다.
III. 결과 및 고찰
1. 타피오카와 겉보리 혼합주정박의 열수 추출물의 미백 활성
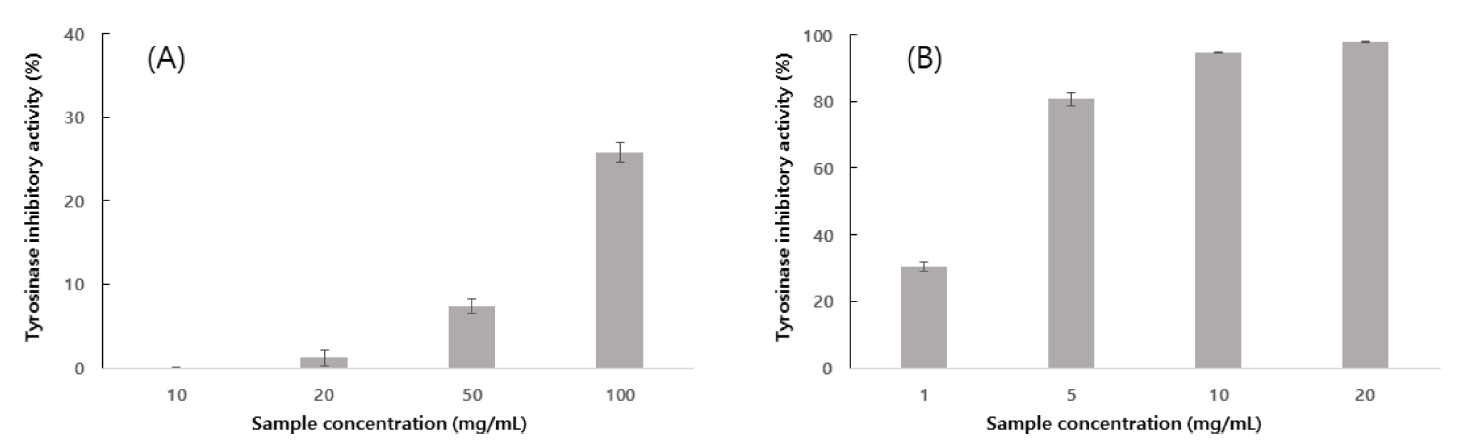
타피오카와 겉보리 혼합주정박의 열수추출물에 tyrosinase inhibitory activity를 측정하기 위하여 mushroom tyrosinase에 의한 L-tyrosine의 산화 정도를 측정하였고 분석결과는 Fig. 1과 같다. 추출물 농도별에 따른 결과 열수 추출물 20 mg/mL에서 1.21%, 50 mg/mL에서 7.39%, 100 mg/mL에서 25.78%로 나타났다. 피부의 색소침착은 피부에 존재하는 멜라닌(melanin) 함량에 의해 영향을 받는다. 일반적으로 피부의 색소변화는 1차 흑화, 2차 흑화로 나눌 수 있다. 1차 흑화는 멜라닌의 생합성을 동반하지 않고 기존 생성된 멜라닌의 산화로 인한 현상을 말하고, 2차 흑화는 tyrosinase에 활성에 의한 melanin의 생합성으로 인한 흑화현상이다(Cho, 2020). 멜라닌은 피부의 기저층에 있는 멜라노좀(melanosome)에서 tyrosine이 tyrosinase촉매작용에 의해 3,4-dihydroxyphenyl alanin 및 dopa quinone을 산화되고 효소 및 산화반응으로 dopachrome, indole carboxylic acid, indolequinone 등이 생성된다. 타피오카와 겉보리 혼합주정박의 열수 추출물이 L-tyrosine을 기질로 사용하여 tyrosinase의 억제 효과를 나타내는 것으로 보아 3,4-dihydroxyphenyl alanin로 산화되는 과정(Kim et al., 2014)을 억제할 수 있을 것으로 사료된다. 식품의약품안전처가 제시한 양성대조군 arbutin은 구조적으로 tyrosin과 유사하여 경쟁적 저해제로 작용하여 tyrosinase 활성을 억제할 수 있다고 알려져 있는 물질이다(Jang, 2019). 본 연구의 열수추출물은 100 mg/mL 농도에서 30%의 저해효과를 나타내었고 이는 대조군인 arbutin의 1 mg/mL농도에서의 나타난 저해율과 비슷한 수치였다. 본 연구의 열수추출물은 arbutin에 비해 낮은 미백활성을 나타내고 있지만 타피오카와 겉보리 혼합주정박의 열수 추출물의 농도 의존적으로 tyrosinase inhibitory activity을 보이고 있으므로 폐기물로 치부된 부산물을 친환경적인 업사이클(upcycle) 제품으로 개발 가능성을 본다면 대조군에 비해 tyrosinase inhibitory activity 활성이 낮더라도 생리활성 기능성 원료로써 잠재력이 있다고 사료된다.
2. 타피오카와 겉보리 혼합주정박의 열수 추출물의 항산화성
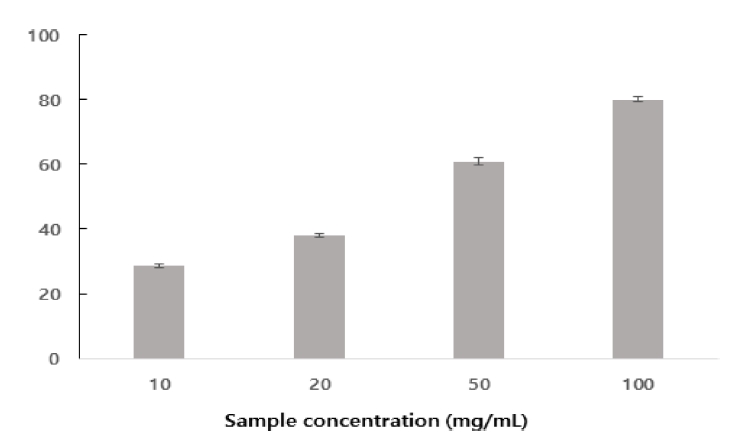
피부의 노화의 주원인은 활성산소와 관련이 있다. 호흡을 통한 생명활동을 하는 호기적 생물체는 호흡 과정 중 공급된 산소가 체내 대사과정 또는 각종 물리적·화학적 환경(자외선, 방사선, 공해, 광화학 반응, 화학약품, 세균 감염) 요인에 의하여 superoxide radical(O2-), hydroxy radical(HO·), hydrogen peroxide(H2O2), singlet oxigen(1O2)와 같은 활성산소종(reactive oxygen species, ROS)이 될 수 있다(Yoo et al., 2005). ROS는 지질산화 반응, DNA 및 단백질의 산화과정을 촉진시켜 피부의 노화를 가속화 시킬 수 있다. 피부의 노화를 지연하기 위해서는 ROS의 생성을 억제하고 생성된 ROS를 제거할 수 있는 항산화제가 필요하다. 항산화제의 방어기전은 ROS와 반응하여 radical에 의한 연쇄반응과 발생을 억제 차단하여 산화적 반응에 의한 생체내 세포조직의 손상을 억제할 수 있다(Hong, 2009). radical에 전자를 공여하여 산화를 억제하는 능력인 DPPH의 라디칼 소거능 및 ABTS 라디칼 소거능을 측정하는 방법을 이용하여 타피오카와 겉보리 혼합주정박의 열수추출물의 항산화성을 분석하였다. 타피오카와 겉보리 혼합주정박의 열수추출물의 농도별 DPPH의 라디칼 소거능 분석결과(Fig. 2) 추출물 10 mg/mL 농도에서 28.7%, 20 mg/mL농도에서 38.0%, 50 mg/mL농도에서 60.9%, 100 mg/mL농도에서는 80.1%로 나타났다. 동충화초물 추출물의 DPPH 라디칼 소거능 보고(Jung & Kim, 2021)에 따르면 대조군 Vit C(1 mg/mL농도)가 96.55%의 소거능을 나타내었고 동충화초 물 추출물 1mg/mL 농도에서 81.26%, 5mg/mL 농도에서 86.01%, 10mg/mL 농도에서 84.99%로 비교적 높은 활성을 나타내었지만 동충화초의 농도에 증가에 따른 DPPH 라디칼 소거능 활성이 증가하지 않았다. ABTS 라디칼 소거능 분석결과(Fig. 3) 추출물 1 mg/mL농도에서 14.4%, 2 mg/mL농도에서 28.7%, 5 mg/mL농도에서 58.2%, 10 mg/mL농도에서는 82.7%로 나타났다. 동충화초 물 추출물의 ABTS 라디칼 소거능의 경우(Jung & Kim, 2021) 대조군 Vit C(1 mg/mL 농도)가 95.87%의 소거능을 나타내었고 열수 추출물 1 mg/mL 농도에서 70.98 %, 5 mg/mL 농도에서 74.92 %, 10 mg/mL 농도에서 74.87 %로 시료량에 따른 활성 증가를 보기가 어려웠다. DPPH 라디컬 소거능의 경우는 타피오카와 겉보리 혼합주정박의 열수추출물에서 소수성 물질에 의한 항산화 활성이 주로 나타나는 것에 비해 ABTS 라디컬 소거능은 친수성 및 소수성 물질에 의한 항산화 활성을 나타나므로 추출물 농도에 따른 항산화 활성 차이(Re et al., 1999)가 난 것으로 판단된다. 타피오카와 겉보리 혼합주정박의 열수추출물이 Vit C와 비교하여 낮은 활성을 나타내지만 항산화활성 활성물질에 기능성소재로써의 가치를 확인할 수 있었다.
DPPH radical scavenging activity of water extract from tapioca-unhulled barley dried distiller's grains with solubles. Each value resents mean±SD of triplcate measurements of analyzed sample.
3. 타피오카와 겉보리 혼합주정박의 열수 추출물의 주름 개선
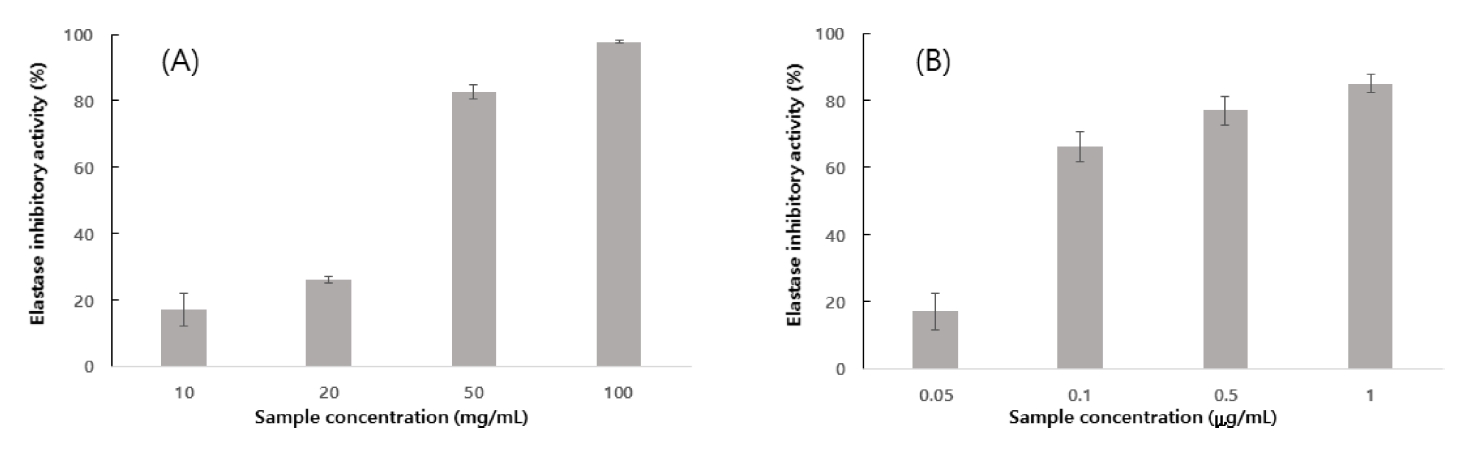
타피오카와 겉보리 혼합주정박의 열수추출물의 주름개선 활성을 측정하기 위하여 collagenase 저해 활성 및 elastase 저해활성을 측정하였다(Fig. 4~5). 본 연구의 타피오카와 겉보리 혼합주정박의 열수추출물의 농도별 collagenase 저해 활성 분석결과 추출물 3 mg/mL농도에서 12.4%, 4 mg/mL농도에서 33.1%, 5 mg/mL농도에서 68.8%, 6 mg/mL농도에서는 92.8%로 나타났다. Collagen은 피부 진피층 세포 외 기질 단백질의 약 90%로 피부를 지지하고 피부의 탄력 및 보습기능을 위한 단백질로 알려져 있다(Jeroma et al., 1998). 이러한 collagen은 collagenase에 의해 분해됨에 따라 주름이 유발하여 피부노화 촉진된다. 본 연구의 타피오카와 겉보리 혼합주정박의 열수추출물은 6 mg/mL 농도에서는 92.8%의 저해활성으로 보아 collagenase의 활성을 저해하여 피부의 주름개선의 활성을 나타냄을 알 수 있다. 대조군 epigallocatechin gallate (EGCG)의 경우 1 μg/mL농도에서 37.8%, 5 μg/mL농도에서 72.2%, 10 μg/mL농도에서 87.5%로 EGCG 비하여 타피오카와 겉보리 혼합주정박의 열수추출물은 낮은 collagenase 저해 활성을 나타내었다. Elastase는 elastin 단백질을 분해하는 효소로 collagen을 분해할 수 있는 비특이적 가수분해효소이다. 피부의 진피속에 있는 collagen과 피부의 탄력성에 관련된 elastin이 그물망 구조를 형성하고 있는데 elastase의 작용으로 구조결합이 끊어지게 되고 이로 인하여 피부의 탄력감이 감소되어 피부주름이 생성될 수도 있다(Jang et al., 2011) 타피오카 와겉보리 혼합주정박의 열수추출물의 농도별 elastase 저해 활성 측정결과(Fig. 5) 추출물 10 mg/mL농도에서 17.2%, 20 mg/mL농도에서 26.1%, 50 mg/mL농도에서 82.7%, 100 mg/mL농도에서 97.8%였다. 대조군인 EGCG는 1 mg/mL농도에서 85%의 elastase 저해 활성을 나타내었다. 타피오카와 겉보리 혼합주정박의 열수 추출물은 농도에 비례하여 collagenase 및 elastase 저해 활성을 나타내므로 타피오카와 겉보리 혼합주정박 열수 추출물의 유의차 있는 주름개선활성을 확인할 수 있다. 국내에서 천연 화장품에 대한 연구개발이 활발하게 이뤄지고 있지만 천연 원료추출이 가지는 원료의 희소성 및 수급불안정에 대한 어려움이 있다. 반면 본 연구의 타피오카와 겉보리 혼합주정박은 비록 대조군에 비해 낮은 생리활성을 가지지만 친환경 소재로써의 화장품 원료로 안정된 원료수급 및 가격 경쟁력에 대한 이점을 고려하여 볼 때 기능성 화장품 원료소재로써 산업적 가치를 가진다고 판단된다.

Collagenase inhibitory activity of water extract from tapioca-unhulled barley dried distiller's grains with solubles (A) and EGCG (B). Each value resents mean±SD of triplcate measurements of analyzed sample.
IV. 결 론
주류제조 가공 중 발생되는 주정박이 가진 생리활성 기능을 활용하여 재활용하거나 재사용하는 등 경제적인 방법을 통해 사회적 비용을 절감과 동시에 주정박의 이용성 증진 및 피부조직의 생리활성개선 기능성 소재개발을 제시하고자 타피오카와 겉보리 혼합주정박의 열수 추출물의 미백활성, 항산화활성 및 주름개선효과를 측정하였다. 타피오카와 겉보리 혼합주정박의 열수 추출물에 tyrosinase inhibitory activity 측정결과 추출물 20 mg/mL에서 1.21%, 50 mg/mL에서 7.39%, 100 mg/mL에서 25.78%로 추출물 농도에 의존적으로 억제활성을 나타내었다. 추출물의 항산화활성 분석 결과 DPPH의 라디칼 소거능 분석 결과 추출물 10 mg/mL농도에서 28.7%, 20 mg/mL농도에서 38.0%, 50 mg/mL농도에서 60.9%, 100 mg/mL농도에서는 80.1%로 나타났다. ABTS 라디칼 소거능 분석결과 추출물 1 mg/mL농도에서 14.4%, 2 mg/mL농도에서 28.7%, 5 mg/mL농도에서 58.2%, 10 mg/mL농도에서는 82.7%로 나타났다. 추출물의 collagenase 저해 활성의 추출물 6 mg/mL농도에서는 92.8%, elastase 저해 활성 측정결과 추출물 농도 100 mg/mL에서 97.8%로 저해활성을 나타내었다. 이상의 결과에서 타피오카와 겉보리 혼합주정박의 열수 추출물의 미백활성, 항산화활성 및 주름개선 효과를 확인을 통하여 생리활성 기능성 소재개발 가능성을 볼 수 있었다.