동충하초 용매 농도별 추출물의 항산화 및 항염활성에 대한 연구
Anti-oxidant and Anti-inflammatory Effects of Cordyceps militaris Extracts
Article information
Trans Abstract
This study investigated antioxidant and anti-inflammatory in order to confirm the possibility of functional materials that can improve skin diseases using Cordyceps militaris extracts. As a result of measuring the total polyphenol content in the solvent extract of Cordyceps sinensis extracted while decreasing the ethanol content, the content was high in 100% water, 30% ethanol, and 50% ethanol extract. As a result of measuring DPPH and ABTS free radical scavenging activities, it was confirmed that 100% water, 30% ethanol, and 50% ethanol extracts had superior antioxidant activity compared to other solvent extracts. In particular, in the case of 50% ethanol extract, it was confirmed that the antioxidant ability was excellent even at a low concentration compared to other extracts. As a result of confirming the efficacy of reducing skin inflammation against 50% ethanol extract using the HaCaT cell line, it was confirmed that the protein level of the CCL17 and CCL22 cytokine increased by TNF-αTNF-α/IFN-γ decreased by 77.8-81.5% and 61.9-67.4%, respectively. In conclusion, the 50% ethanol extract of Cordyceps militaris is likely to be used as a functional material related to skin diseases in the future.
I. 서 론
세포 신호와 항상성에서 중요한 임무를 수행하는 것으로 알려진 활성산소종(reactive oxygen species, ROS)은 생체 내에서 정상적인 대사 과정에서 생성되는 것으로 알려져 있으나, 외부 자극으로 인해서 생성되는 이차대사산물이기도 하다(Papa and Skulachev, 1997). 생체 내 활성산소는 자외선 및 높은 열과 같은 환경적 스트레스, 산화된 식품 섭취, 음주, 흡연 등 다양한 원인에 의해 지속해서 생성되게 되며, 이들은 생체 내에서는 제거됨으로써 생성과 제거 간의 균형을 유지하게 된다(Borrello et al., 1984; Gordon, 1996; Aruoma, 1991). 그러나 병리학적 상태에서 생성된 과량의 활성산소가 완전하게 제거되지 못하는 경우 생체 내 활성산소의 불균형 상태인 산화스트레스를 초래하게 되며, 이 현상을 통해 과도하게 늘어난 활성산소는 DNA, 단백질, 지질과 반응을 일으켜 생명체의 몸에 유해한 물질로 작동할 수 있다(Rhee, 2006; Ozben, 2007). 이처럼 생체 내에 생성된 산화스트레스는 생체 내 혈관 및 조직의 손상을 통해 염증을 유발할 수 있으며, 더 나아가 암, 동맥경화, 심장질환, 당뇨병 등 다양한 질병과 노화를 유발하는 원인이 되기도 한다(Mahakunakorn et al., 2004; Cencioni et al., 2013; Kalyanaraman 2013).
피부는 신체에서 가장 큰 단면적을 지닌 1차 방어조직이자 면역기관으로 미세먼지 등 유해환경으로부터 신체를 보호하고, 박테리아나 바이러스 등이 몸속으로 침투하지 못하도록 막는 방어체계이다. 피부 면역체계의 이상은 외부자극에 대해 적절한 대응을 하지 못하게 할 뿐만 아니라, 아토피 피부질환, 알레르기 피부염 등 염증성 피부질환의 발생을 초래하기도 한다(Holgate, 2012; Saeki and Tamaki, 2006; Hartl et al., 2009). 피부염증 완화를 위해서는 스테로이드제 및 항히스타민제가 사용됐으나, 장기 사용에 의한 피부 발진, 색소침착, 알레르기 등의 부작용이 알려져 있어 부작용이 없으며 장기 사용할 수 있는 소재 개발이 필요한 실정이다. 소재 개발을 위한 연구에는 표피세포의 약 95%를 차지하며 여러 사이토카인들을 생산하고 면역 및 염증반응에 관여하는 피부암 유래 각질 세포주인 HaCaT (Human Keratinocyte cell line) 세포를 사용한다. 피부의 각질세포는 다양한 외부 유해자극에 의해 Th2 케모카인으로 알려진 CCL17과 CCL22을 분비하며, 이 사이토카인들은 Th2 세포의 염증 부위로의 이동과 침윤을 유도하는 것으로 알려져 있다. 최근에는 아토피 피부염 환자의 혈청에서 CCL17과 CCL22가 매우 높은 농도로 검출되어 아토피피부염과 CCL17, CCL22가 서로 매우 밀접한 관련이 있는 것으로 보고되고 있다(Abelius et al., 2011; Song et al., 2005).
동충하초(Cordyceps militaris)는 동충하초과의 작은 버섯으로, 한국 및 일본, 중국 등 전 세계에 분포하며 대부분 곤충에 기생하여 기주의 영양분을 이용하여 자실체를 형성하는 것으로 알려져 있다. 동충하초는 항암효과, 면역증강 효과, 항바이러스효과 및 항염효과 등 다양한 생리활성이 보고되고 있어 최근에는 기능성식품 및 기능성 화장품 소재로 주목받고 있다. 동충하초의 주요한 성분으로는 Cordycepin이라는 화합물이 알려져 있으며, 항산화, 항암, 혈당강화, 면역증강, 항균효과 및 파골세포분화억제 활성 등이 보고되어 있다(Jeong and Choi, 2015; Kim et al., 2012; Choi et al., 2012). 따라서 본 연구에서는 동충하초 추출물에 대한 피부질환 개선용 소재로서의 가능성을 확인해 보고자 동충하초 용매 농도별 추출물에 대하여 항산화 활성과 HaCaT 세포를 이용한 항염활성을 살펴보았다.
II. 재료 및 방법
1. 시약 및 기기
Folin & Ciocalteu’s phenol 시약, Sodium carbonate, gallic acid, 2,2-diphenyl-1-picrylhydrazyl (DPPH), 2,2'-azino-bis(3- ethylbenzothiazoline-6-sulfonate) (ABTS), 2,4,6-tris(2-pyridyl)-s-triazine (TPTZ), Vitamin C, K2S2O8, Cordycpein은 Sigma-Aldrich Co., LLC (St. Louis, MO, USA), Dulbecco’s modified Eagle Medium (DMEM)은 Gibco Co., Ltd., NaNO2, DMSO는 Samchun Pure Chemical Co., Ltd. (Pyeongtaek, Korea), 아세토나이트릴(CH3CN)과 에탄올(ethanol)은 Duksan Pure Chemicals Co., Ltd. (Ansan, Korea)것을 사용하였다.
2. 시료의 제조
본 실험에서 사용된 동충하초는 시중에서 구입하여 실험에 사용하였다. 건조된 동충하초를 믹서기로 파쇄하고 각각의 파쇄된 분말 100 g에 100% 물, 30% 에탄올, 50% 에탄올, 80% 에탄올 및 95% 에탄올을 각각 800 mL를 첨가한 후 70°C에서 3시간 동안 가열 추출하였다. 추출액은 다시 여과지(Whatman NO. 2)로 여과하여 38°C에서 감압 농축한 다음 농축된 시료를 freeze dryer로 수분을 제거하고 분말화하여 –20°C에서 보관하고 에탄올에 녹여 실험에 사용하였다.
3. 총 폴리페놀 함량 측정
시료의 총 폴리페놀 화합물 함량의 측정은 Folin과 Denis의 방법(Folin and Denis, 1912)을 일부 수정하여 수행하였다. 2 N Folin-Ciocalteu’s phenol reagent(Sigma-Aldrich Co.)와 증류수를 1:2로 섞은 혼합액 10 μL에 시료 10 μL를 넣고 암실에서 3분간 방치한 뒤 20% sodium carbonate(Na2CO3, Sigma-Aldrich Co.) 150 μL를 가하고 1시간 동안 암소에서 반응시켰다. 이후 ELISA reader(Microplate Absorbance Spectrophotometer, BioRad Laboratories, Inc., Hercules, CA, USA)를 사용하여 765 nm에서 흡광도를 측정하였다. 측정한 흡광도는 gallic acid(Sigma-Aldrich Co.)를 이용하여 작성한 표준검량곡선으로부터 시료의 총 폴리페놀 화합물의 농도(mg GAE/mL)를 구하였다.
4. 항산화활성
1) DPPH radical 소거능
DPPH radical 소거능은 Blois방법(Blois, 1958)에 준하여 측정하였다. 0.15 mM DPPH (Sigma-Aldirich Co.) 용액 190 μL와 각 농도별 시료 10 μL를 넣어 교반한 뒤 암실에서 30분간 반응시킨 후 ELISA reader (Bio-Rad Laboratories, Inc.)를 사용하여 517 nm에서 흡광도를 측정하였다. 시료의 항산화능은 항산화제로 잘 알려져 있는 vitamin C의 항산화 능을 측정한 값과 비교하였다.
2) ABTS radical 소거능
2,2'-Azinobis(3-ethylenbenzothizoline-6-sulfonate)(ABTS) radical 소거능 측정은 Pellegrini 등의 방법(Pellegrini et al., 1999)에 준하여 측정하였다. ABTS solution은 7 mM ABTS (Sigma-Aldrich Co.) 10 mL와 140 mM K2S2O8 (Sigma-Aldrich Co.) 176 μL를 혼합하여 암소에서 14-16시간 이상 반응시킨 후 이 용액과 에탄올을 1:8 8 비율로 혼합하여 제조하였다. ABTS solution 200 μL를 취하여 각 농도별 시료 10 μL를 혼합하여 암실에서 2분 30초간 방치한 후 ELISA reader(Bio-Rad Laboratories, Inc.)를 이용하여 734 nm에서 흡광도를 측정하였다. 시료의 항산화능은 항산화제로 잘 알려져 있는 vitamin C의 항산화 능을 측정한 값과 비교하였다.
3) FRAP 활성
Ferric reducing antioxidant potential (FRAP)은 Benzie와 Strain의 방법에 준하여 측정하였다(Benzie and Strain, 1996). FRAP reagent는 300 mM sodium acetate buffer (pH 3.5)와 10 mM 2,4,6-tris(2-pyridyl)-s-triazine(TPTZ) (Sigma-Aldrich Co.), 20 mM FeCl3·6H2O를 각각 10:1:1(v/v/v)의 비율로 혼합하여 제조하였다. 농도별로 희석한 시료 30 μL와 FRAP reagent 300 μL를 혼합하여 37°C에서 10분간 반응시킨 후 593 nm에서 흡광도를 측정하였다. FRAP value는 표준물질인 iron(II) sulfate heptahydrate (FeSO4·7H2O)을 사용하여 측정한 표준검량곡선에 대입하여 얻었다.
5. 항아토피 활성
1) 세포 배양 및 생존률 측정
Human keratinocyte cell line인 HaCaT cell은 10% heat-inactivated FBS와 1% penicillin-streptomycin이 첨가된 DMEM(Dulbecco’s modified Eagle Medium) 배지에서 37°C, 5% CO2 조건하에 배양하였다. 배양이 끝난 세포의 생존률은 MTT [3-(4,5-dimethylthiazole-2-yl)-2,5-diphenyl-tetrazolium bromide] 환원 방법을 이용하여 측정하였다. HaCaT cell을 96-well plate에 3×104 cells/well로 분주하고 37°C에서 배양한 후 동충화초 50% 에탄올 추출물을 30, 60 μg/mL로 처리하고 24시간 동안 배양하였다. 24시간 후 각 well에 20 μL의 MTT 용액을 첨가하고 3 시간 동안 추가로 배양한 후 배양액을 제거하고 100 μL의 DMSO(dimethylsulfoxide)를 첨가하여 formazan을 녹인 후 540 nm에서 흡광도를 측정하였다.
2) CCL17, CCL22 ELISA assay
세포 내 CCL17, CCL22 정량은 ELISA법으로 측정하였다. 먼저, HaCaT 세포를 6 well plate에 각 well 당 1.5×105 cells/mL로 분주한 뒤, 5% CO2, 37°C 조건 하에서 24시간 동안 배양하였다. 50% 에탄올 추출물을 농도별 (30, 60 μg/mL)로 1시간 전 처리한 후 염증반응 유도 군에서는 TNF-α, INF-γ 50 ng/mL를 1시간 동안 처리하였다. 배양 후 media를 15 mL tube에 넣고 1,500 rpm, 10분 동안 원심분리 하였다. 배양액 내의 CCL17 및 CCL22 함량을 측정하기 위해 Human CCL17/TARC Quantikine ELISA kit 및 Human CCL22/MDC Quantikine ELISA kit(R&D Systems, Minneapolis, MS)를 사용하여 측정하였다. 실험과정은 세포배양액을 각 well에 분주하고 제공되는 표준시료를 주입하여 제조회사에서 제시하는 방법에 준하여 450 nm 파장에서 흡광도를 측정하였다.
6. HPLC 분석
동충하초 50% 에탄올 추출물은 YL 9100 HPLC stsyem(YL instrument co., LTD.)을 사용하여 분석하였다. HPLC 분석컬럼으로는 Capcellpak C18 UG120(250 mm×4.6 mm, 5 μm, Shiseido) 컬럼을 사용하였고, 컬럼 오븐 온도는 28°C, 분석파장은 260 nm, Injection volume은 20 μL, Flow rate는 1 mL/min으로 설정하였으며, 아세토나이트릴(CH3CN)을 분석용매로 사용하였다.
7. 통계처리
본 연구에서 얻어진 실험결과는 평균(mean)±표준편차(standard deviation; SD)로 표기하였으며, 통계처리는 SPSS 24.0 for windows program (Statistical Package for the Social Science, IBM SPSS, USA)을 이용하여 통계적 유의성을 분석하였다. 일원배치 분산분석(one-way analysis of variance)을 한 후, 각 시료 간의 통계적 유의성은 Tukey's multiple comparison test를 이용하여 사후검증을 수행하였다.
III. 결과 및 고찰
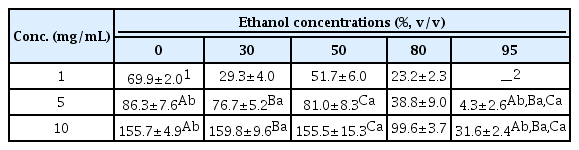
1. 동충하초 용매별 추출물의 총 폴리페놀 함량 분석
페놀성 화합물은 식물계에 널리 알려진 2차 대사산물로써, 항산화, 항염, 항균, 간 기능 보호 작용 및 혈중 지질 분해 작용 등 다양한 생리활성이 보고되고 있다(Manach et al., 2005; Kang et al., 2017). 이에 에탄올 함량을 낮춰가며 추출한 동충하초 용매 추출물들을(95%, 80%, 50%, 30% 에탄올, 100% 물) 1, 5, 10 mg/mL 농도로 조제 후 총 폴리페놀 함량을 측정하였으며, 이 추출물들의 총 폴리페놀 함량은 Table 1에 정리하였다. 측정 결과, 100% 물 추출물의 총 폴리페놀 함량은 1, 5, 10 mg/mL 농도에서 69.9, 86.3, 155.7 GAE mg/mL로 가장 높게 측정되었으며, 그 다음으로 50% 에탄올 추출물이 각각의 농도에서 51.7, 81.0, 155.5 GAE mg/mL로 측정되어 100% 물 추출물 다음으로 높게 측정되었다. 30% 에탄올 추출물은 각각의 농도에서 29.3, 76.7, 159.8 GAE mg/mL로 측정되었으며, 80% 에탄올 추출물은 각각의 농도에서 23.2, 38.8, 99.6 GAE mg/mL로 측정되었고, 95% 에탄올 추출물은 5, 10 mg/mL 농도에서만 각각 4.3, 31.6 GAE mg/mL로 측정되었다. 이상의 결과 100% 물, 30% 에탄올 및 50% 에탄올 추출물의 총 폴리페놀 함량이 80% 및 95% 에탄올 추출물과 비교하여 각각 약 1.6배, 약 5.0배 증가하는 것으로 측정되었으며(각 추출물 10 mg/mL 농도 기준), 에탄올 함량이 낮아지고 물 함량이 높아질수록 동충하초의 폴리페놀성분들이 더 많이 추출된다고 보고된 기존의 연구결과들과 유사한 결과를 얻을 수 있었다. 또한, 총 폴리페놀 화합물의 함량이 증가하면서 항산화 활성도 증가한다는 연구결과가 보고되고 있어(Choi et al., 2015), 각각의 에탄올 추출물에 대한 항산화 활성과 총 폴리페놀 함량을 비교 분석하였다. 따라서 각각의 동충하초 에탄올 추출물의 폴리페놀 성분 함량과 생리 활성과의 상관관계를 확인하기 위하여 다양한 항산화활성을 측정하였다.
2. 동충화초 용매별 추출물의 항산화 활성
동충화초 에탄올 추출물에 대하여 피부에 효과적인 기능성 소재로 활용하기 위해 DPPH, ABTS 및 FRAP radical 소거능 측정을 통해 항산화 효능을 평가하였다.
1) DPPH radical 소거능
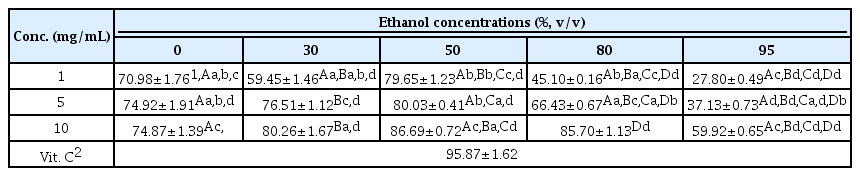
화학적으로 안정화된 자유라디칼을 갖는 물질인 DPPH는 다양한 추출물에 함유된 화합물들로부터 전자를 받아 비 radical 형태로 변하면서 색상이 변화하게 되고, 변화의 정도를 분광학적으로 측정하는 방법으로 다양한 천연 소재로부터 항산화물질을 검색하는 데 많이 이용되고 있다. 각각의 추출물에 대하여 DPPH 항산화 활성을 측정한 결과(Table 2), 10 mg/mL 농도에서는 8 0% 에탄올 > 50% = 30% 에탄올 > 100% 물 > 95% 에탄올 추출물 순으로 DPPH 항산화 활성이 높게 나타내었다. 또한, 각 추출물에 대하여 5 mg/mL 농도로 낮추어 DPPH 항산화 활성을 비교해본 결과, 100% 물, 30% 및 50% 에탄올 추출물의 경우 80% 에탄올 추출물과는 약 12-13%의 DPPH 항산화 활성이 높았으며, 95% 에탄올 추출물과 비교하여 약 23% 높은 DPPH항산화 활성을 나타내었다. 그리고 1 mg/mL 농도에서는 100% 물, 30% 및 50% 에탄올 추출물의 경우 DPPH 항산화 활성이 78.79%-81.26%로 측정되었으며, 80% 에탄올 및 95% 에탄올 추출물에서는 각각 61.07% 및 59.35%로 측정되었다. 본 실험은 대조구로 vitamin C를 사용하였으며, 대조구의 경우 1 mg/mL 처리에 의해서는 96.55%로 높은 DPPH 항산화 활성을 보였다. 이상의 결과(Table 2)에서 살펴보듯이, 100% 물, 30% 에탄올 및 50% 에탄올 추출물이 다른 추출물과 비교하여 낮은 농도에서도 DPPH 항산화 활성이 높은 것으로 확인되었으며, 이것은 물 함량이 높아짐에 따라 추출되는 폴리페놀 성분의 차이에 의해서 DPPH 항산화 활성이 영향을 받는 것으로 사료된다.
2) ABTS radical 활성
ABTS는 유리기들과의 반응으로 생성된 양이온 형태의 ABTS가 추출물에 함유된 다양한 활성화합물에 의해 환원되는 정도를 측정하는 것으로 DPPH와 함께 대표적으로 항산화 활성을 측정하는 방법으로 알려져 있다. 각각의 추출물은 1, 5 및 10 mg/mL 농도에서 ABTS radical 소거능을 통해 항산화 활성을 분석하였다(Table 3). 이 중 50% 에탄올 추출물은 농도 의존적으로 가장 높은 활성을 나타내었으며, 그 ABTS radical 소거능은 각각의 농도에서 79.65%, 80.03% 및 86.69%로 측정되었다. 그 다음으로 높은 활성을 보인 100% 물 추출물의 ABTS radical 소거능은 70.98%, 74.92% 및 74.87%로 나타내었으며, 30% 에탄올 추출물은 각각의 농도에서 59.45%, 76.51%, 80.26%의 ABTS radical 소거능을 나타내었다. 80% 에탄올 추출물은 처리된 농도에서 45.10% - 85.70%의 ABTS radical 소거능을 보였으며, 95% 에탄올 추출물은 27.80%-59.92%로 가장 낮은 ABTS radical 소거능을 나타내었다. ABTS radiclal 소거능이 가장 높은 50% 에탄올 추출물의 경우 DPPH radical 소거능과 비교하여 낮은 농도인 1 mg/mL에서는 유사한 ABTS radical 소거능을 보였으나, 5 및 10 mg/mL 농도에서 약 3.5%-7.9% 정도 낮은 소거능을 나타내었다. 또한, 100% 물 추출물의 경우 처리된 농도에서 약 10%-11% 낮은 ABTS radical 소거능을 보였으며, 30% 에탄올 추출물은 5 및 10 mg/mL 농도에서는 약 10%, 1 mg/mL 농도에서는 18.9% 낮은 radiclal 소거능을 확인할 수 있었다. 80% 에탄올 추출물 및 95% 에탄올 추출물은 1 mg/mL 농도에서 각각 약 16.0% 및 31.5% 낮은 ABTS radicla 소거능을 나타내었다. 이와 같인 각각의 추출물은 DPPH radical 소거능과 비교해보면 전체적으로 낮은 ABTS radical 소거능을 보였다(Table 2 and Table 3). ABTS radical은 추출물에 함유된 극성 및 비극성 물질 모두와 반응하여 소거되는 것으로 보고되고 있으나, 본 연구의 동충하초 추출물들은 물과 에탄올 함유 비율에 따른 극성 차이와 추출되어 나온 성분의 차이로 인하여 DPPH radical 활성과 비교하여 낮은 활성을 보인 것으로 사료된다.
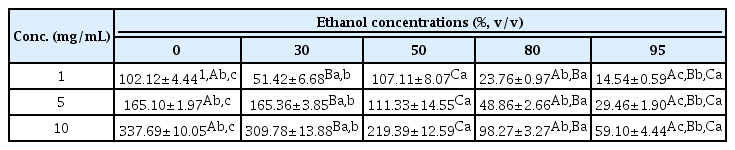
3) FRAP 활성
FRAP (Ferric reducing ability of plasma) 분석법은 낮은 pH 조건하에서 Fe3+-TPTZ (ferric tripyridyltrizaine) 복합체가 화합물에 의해 Fe2+-TPTZ (ferrous tripyridyltriazine) 으로 환원될 때 흡광도 변화를 측정하는 방법으로 전자공여 능을 통해 항산화 능력을 검증하는 것이다. 본 연구에서는 다른 항산화 활성 측정법과 동일하게 각각의 추출물을 1, 5 및 10 mg/mL 농도에서 FRAP 활성을 측정하였다(Table 4). 가장 높은 활성을 보인 100% 물 추출물은 각각의 농도에서 102.12, 165.10 및 337.69 μg/mL로 측정되었으며, 30% 에탄올 추출물은 51.42, 165.36, 309.78 μg/mL 그리고 50% 에탄올 추출물은 107.11, 111.33, 219.39 μg/mL로 측정되었다. 그 다음으로 8 0% 에탄올 추출물은 처리된 농도에서 23.76, 48.86, 98.27 μg/mL로 측정되었으며, 가장 낮은 활성은 95% 에탄올 추출물은 14.54, 38.87, 59.10 μg/mL로 측정되었다. DPPH, ABTS 항산화 활성과 유사하게 100% 물, 30% 에탄올 및 50% 에탄올 추출물에서 다른 추출물과 비교하여 더 높은 FRAP 활성을 나타냈다. 100% 물 및 30% 에탄올 추출물의 경우 5-10 mg/mL 농도에서는 50% 에탄올 추출물과 비교하여 높은 활성을 나타내었으나, 1 mg/mL 농도에서는 100% 및 50% 에탄올 추출물이 30% 에탄올 추출물과 비교하여 약 2배 높은 FRAP 활성을 나타냈으며, 80% 및 95%에탄올 추출물은 DPPH 및 ABTS 항산화활성과 유사한 경향으로 FRAP에서도 낮은 활성을 나타냈다(Table 4). FRAP 항산화 활성 또한 DPPH 및 ABTS 항산화 활성과 유사하게 동충화초 추출을 위한 용매의 극성이 높아짐에 따라 추출되는 폴리페놀 성분의 차이에 의한 결과로 생각된다.
3. TNF-α/INF-γ 유도된 HaCaT 세포에서 동충하초 50% 에탄올 추출물의 효능
CCL17과 CCL22는 피부각질 세포를 포함하는 다양한 세포에서 발현되는 케모카인으로써 Th2 림프구의 염증 부위로의 이동과 침윤을 유도하는 것으로 알려져 있으며, 이들은 염증성 피부질환인 아토피 피부염 환자의 혈청에서 매우 높은 농도로 검출되어 아토피 피부염과 매우 밀접한 관련이 있는 것으로 보고되고 있다(Abelius et al., 2011; Song et al., 2005). 각각의 동충화초 추출물에 대한 총 폴리페놀 함량 분석 및 항산화 활성 검증 결과를 살펴보면, 100% 물 추출물 및 50% 에탄올 추출의 경우 다른 추출물과 비교하여 낮은 농도에서도 폴리페놀 함량 및 항산화 활성이 우수한 것을 확인할 수 있었다(Table 1-4). 이 중 50% 에탄올 추출물에 대하여 피부세포인 HaCaT 세포에서 CCL17 및 CCL22 단백질 생산 변화에 영향을 미치는지 ELISA assay를 통해 확인하였다(Fig. 1). MTT assay를 이용한 세포독성 측정결과, 동충화초 50% 에탄올 추출물은 30, 60 μg/mL 농도에서 70% 이상의 세포생존율을 나타내 처리한 농도에서는 세포독성을 나타내지 않는 것을 확인하였다. HaCaT 세포는 아무런 처리도 하지 않은 대조군에 비하여 TNF-α/IFN-γ를 동시에 처리한 실험군에서 CCL17과 CCL22의 단백질 생산량이 각각 4.19 pg/mL 및 50.56 pg/mL로 측정되었다. 대조군으로 사용된 cyclosporin은 10 μM 처리 시 CCL17과 CCL22의 단백질 생 산량이 각각 1.63 pg/mL 및 23.89 pg/mL로 측정되었으며, TNF-α/IFN-γ만 처리한 실험군과 비교하여 CCL17 과 CCL22의 단백질 생산량이 각각 38.9% 및 47.25% 감소한 것으로 확인되었다. 동충하초 50% 에탄올 추출물을 30 및 60 μg/mL 농도로 처리 시 TNF-α/IFN-γ에 의해 증가된 CCL17을 농도 의존적으로 감소시켰으며, CCL17 생산량은 각각 0.93 pg/mL 및 0.78 pg/mL로 측정되었다. 또한 CCL22의 생산량은 각각 19.26 pg/mL 및 16.48 pg/mL로 측정되었다(Fig. 1). 동충하초 50% 에탄올 추출물은 TNF-α/IFN-γ만 처리한 실험군과 비교하여 CCL17 생산량은 77.8% 및 81.5% 감소시켰으며, CCL22의 생산량은 각각 61.9% 및 67.4% 감소한 것으로 확인되었다. 이와 같이 동충하초 50% 에탄올 추출물은 대조군으로 사용된 cyclosporin과 비교하여 CCL17 과 CCL22의 단백질 생산량 억제 효과가 더 높게 측정되었으며, 이를 통해 동충하초 50% 에탄올 추출물이 피부염증 질환인 아토피피부염 개선효능이 있을 것으로 판단된다.

Effects of 50% EtOH extract on CCL17 and CCL20 production in TNF-α/IFN-γ induced HaCaT cells. The cells were stimulated with 50 ng/mL of TNF-α/IFN-γ only, and TNF-α/IFN-γ plus cyclosporin (10 μM, positive control) or 50% EtOH extract (30 and 60 μg/mL) for 1 h. CCL17 and CCL20 protein production was determined by the Human CCL17/TARC Quantikine ELISA kit and Human CCL22/MDC Quantikine ELISA kit. The data represent the mean ± SD of triplicate experiments.
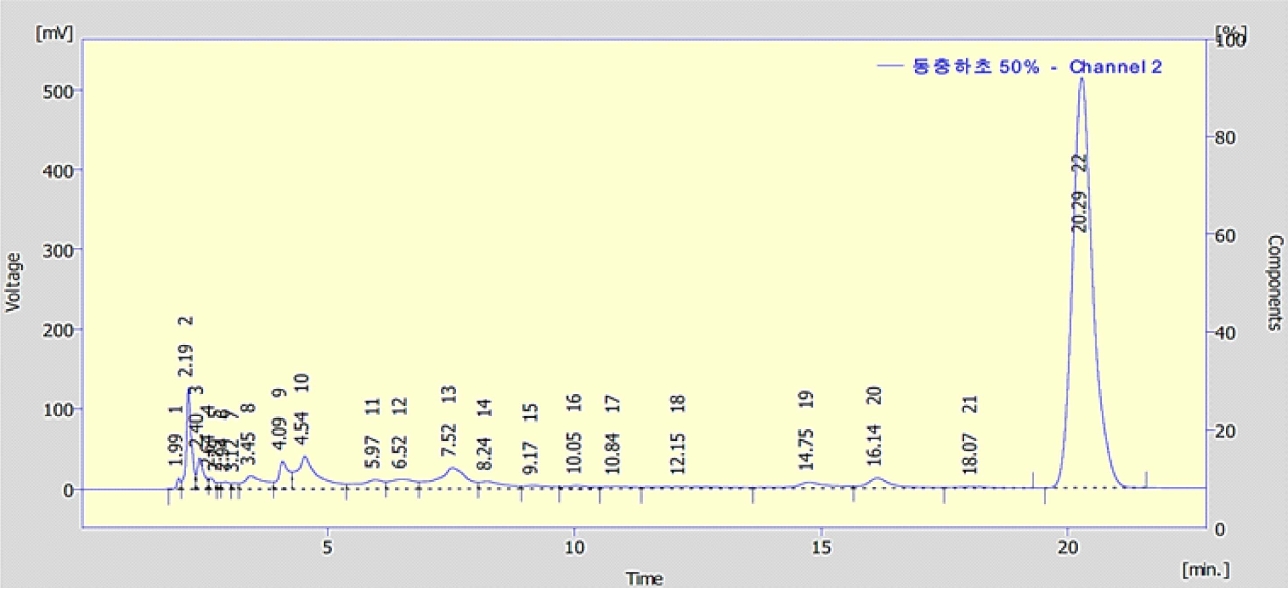
4. 동충화초 추출물의 HPLC 성분 분석
동충하초 추출물 중 효능을 보이는 50% 에탄올 추출물의 성분을 분석하기 위해 HPLC 크로마토그램을 실시하였다. 그 결과 Fig. 2에서 보는 바와 같이 HPLC 크로마토그램에서 1개의 peak을 확인하였으며, 그 peak의 성분을 확인하기 위해 동충하초의 지표성분으로 알려진 화합물인 Cordycepin 표준물질을 구매하여 실험하였다. 그 결과 동충하초의 주성분으로 알려진 Cordycepin임을 확인하였으며, 50% 에탄올 추출물의 Cordycepin 함량은 측정 결과 5.7%로 확인되었다.
IV. 결 론
본 연구는 동충하초를 이용하여 피부질환을 개선하는 기능성 소재의 가능성을 확인하고자 항산화 및 항염증에 대해 조사하였다. 동충하초는 에탄올 함량을 낮춰가며 용매추출을 하였으며(100% 물, 30% 에탄올, 50% 에탄올, 80% 에탄올 및 95% 에탄올), 각각의 용매추출물 에 대한 총 폴리페놀 함량을 측정한 결과 100% 물, 30% 에탄올, 50% 에탄올 추출물에서 높은 함량을 나타내었다. 항산화 효능인 DPPH 와 ABTS free radical 소거활성을 측정한 결과, 100% 물, 30% 에탄올, 50% 에탄올 추출물이 다른 용매 추출물과 비교하여 우수한 항산화 활성을 가지는 것을 확인하였다. 이를 통해 총 폴리페놀 함량이 높을수록 항산화 효능이 높아짐을 확인하였으며, 특히 50% 에탄올 추출물의 경우 다른 추출물과 비교하여 낮은 농도에서도 항산화 능력이 우수함을 확인하였다. 따라서 50% 에탄올 추출물에 대해 피부각질 세포인 HaCaT 세포주를 이용해 피부염증 완화 효능을 검증하였다. TNF-α/IFN-γ를 동시에 처리한 HaCaT 세포의 경우 염증성 피부질환과 밀접한 관련성이 있는 사이토카인인 CCL17과 CCL22의 단백질 수치가 증가하였으며, 50% 에탄올 추출물을 농도별로 처리시 그 수치가 각각 77.8-81.5%(CCL17) 및 61.9-67.4% (CCL22) 감소되는 것을 확인하였다. 이러한 결과를 보면, 총 폴리페놀 함량 높은 50% 에탄올 추출물에서 항산화 및 항염이 우수한 활성을 나타내며 다른 추출물과 비교하여 활성물질이 다수 포함하고 있을 것으로 생각되며 추가적인 활성 물질에 관한 연구가 필요할 것으로 사료된다. 결론적으로 동충화초 50% 에탄올 추출물은 향후 피부질환에 관련된 기능성 소재로서 사용될 가능성이 사료된다.