물김치 유래 Lactic acid bacteria의 Heat-killed cell 항산화능 평가
Evaluation of the Antioxidant Activity of Lactic Acid Bacteria Heat-Killed Cells Derived from Mulkimchi
Article information
Trans Abstract
In order to use lactic acid bacteria isolated from Mulkimchi as a raw material for cosmetics, strain screening was carried out. And we measured the antioxidant activity of the lactic acid bacteria heat-killed cells obtained by heating lactic acid bacteria isolated from Mulkimchi. Among lactic acid bacteria derived from Mulkimchi, 41 strains were selected based on the culture suitability such as growth rate and antibiotic resistance. DPPH assay, ABTS assay, nitrite radical scavenging activity assay, and total phenolic contents were measured for 41 strains. Based on Lactobacillus plantarum LP299v, 1 strain was selected through DPPH assay, 1 strain through ABTS assay, 1 strain through nitrite radical scavenging activity assay, and 1 strain through total phenolic contents measurement. Among these, we isolated Lactobacillus sp. P100, which showed excellent antioxidant activity in all experimental methods, and the result of identification through 16s rRNA showed Lactobacillus plantarum. The strain showed 3-10% better antioxidant activity than Lactobacillus plantarum LP299v. And we measured the cell toxicity and anti-inflammatory activity. Lactobacillus sp. P100 showed the lowest cell toxicity and the highest NO production inhibitory rate. In other words, we could isolate lactic acid bacteria that can be used as an antioxidant ingredient in cosmetics from Mulkimchi.
I. 서 론
외부 자극에 대한 반응 및 적응은 생물의 생존에 중요한 요소이다. 하지만 현대인은 공기의 오염, 오존층 파괴로 인한 자외선 노출, 미세먼지 등 피부에 가해지는 자극이 증가하고 있다. 과거의 화장품 역시 이러한 피부 자극 요인 중 하나로, 화학적으로 합성된 BT A, 파라벤, 프탈레이트 등 화장품의 원료들이 피부뿐만 아니라 내분비 교란, 발암 등 유해한 작용을 한다는 것이 알려지며, 화장품 성분을 중요하게 여기는 소비자가 증가하고 있다. 이에 소비자들은 피부에 자극이 적으며 천연물에서 유래된 화장품 원료에 대한 요구가 증가하고 있다.
유산균은 비타민만큼이나 일상적으로 챙겨 먹어야 하는 건강보조식품으로 자리 잡으며, 건강증진뿐만 아니라 피부 개선을 위한 이너뷰티 제품으로도 활용되고 있다(Jeon et al., 2019). 또한 향장소재로서 이용 가능성이 높다는 다양한 연구 결과들이 보고되고 있다(Suk & Kang, 2018). 동시에 유산균의 응용 방법 역시 다양화되기 시작하였다. 과거에는 생균을 섭취하였을 때 얻을 수 있는 효과에 대한 연구에 국한되어있었으나, 현재는 생균뿐만 아니라 생균에 특이적으로 사용되는 영양분, 유산균의 사균체 등 다양한 상태의 유산균 섭취에 대한 연구가 진행되고 있으며, 섭취뿐만 아니라 피부에 도포하였을 경우 얻을 수 있는 효과에 대한 연구도 진행되고 있다.
김치는 대한민국의 전통음식으로 채소류를 소금에 절여 다양한 부재료와 향신료와 같이 발효를 시킨 발효식품이다(Lee & Ahn, 1995). 그 예로 배추를 주원료로 하는 김치는 30종의 부재료가 들어가며, 무를 주재료로 하는 김치는 20종의 부재료가 들어간다(Jo & Hwang, 1988). 다양한 주재료와 부재료는 김치에서 유산균이 증식할 수 있는 환경을 만들어 주며(Han et al., 2005), 김치의 종류에 따라 다양한 특징을 가진 유산균이 자라도록 도와준다(Ko et al., 2013).
김치의 제조과정 중 채소의 절임과정에 의해 삼투압 변화에 내성을 지닌 유산균의 비율이 증가한다(Kim et al., 2010). 이때 자라는 유산균은 크게 Leuconostoc 속, Lactobacillus 속, Weissella 속, Lactococcus 속, Pediococcus 속, Enterococcus 속이 존재하지만, 균총이 안정화되는 13일 이후로는 Leuconostoc 속과 Lactobacillus 속이 50% 이상을 차지한다(Jung et al., 2011). Lactobacillus plantarum은 내산성과 내염성이 뛰어나며(Karasu et al., 2010), 채소에서 자주 발견되며, 채소발효식품 생산과정에서 접종 없이 발효가 일어나는 원인이다(Sanchez et al., 2000; Panagou et al., 2006). 동시에 인체에 유익한 도움을 주는 probiotics의 특성을 지니고 있고(Ouwehand et al., 1999; De Vries et al., 2006), L. plantarum의 사균체 또한 면역반응을 조절하여 paraprobiotic 활성을 보인다(Murosaki et al., 1998). 동시에 이러한 사균체에서 항산화능이 있음이 밝혀졌다(Lin & Pan, 2010).
세포는 정상적인 활동을 하는 중에도 hydrogen peroxide (H2O2), superoxide ion (O2-), hydroxide radical (·OH)과 같은 reactive oxygen species (ROS)를 생성한다(Chance et al., 1979; Cadenas & Davies, 2000). 뿐만 아니라 ultraviolet A(UVA)와 antigen과 같은 외부적 요인에 의해서도 ROS 생성이 유도된다(Scharffetter-Kochanek et al., 1993). ROS는 collagenase의 합성을 유도하여 피부를 노화시키며(Wlaschek et al., 1995), melanogenic enzyme의 transcription을 촉진시켜 피부를 검게 만드는 원인이기도 하다(Panich et al., 2011). 이러한 ROS를 제거하기 위해 화장품에는 다양한 항산화제를 첨가한다(Draelos & Thaman, 2005).
김치에서 분리한 Lactobacillus 속에 대한 연구에 따르면, 다양한 항산화 실험에서 화장품으로 응용되기에 충분한 항산화능을 나타내었다(Lim, 2010; Kim et al., 2013; Ji et al., 2015). 유산균의 표면에는 exopolysaccharide (EPS)라는 물질을 포함하고 있으며(Lebeer et al., 2008), 그 EPS가 항산화능을 띄는 물질로 알려져 있다(Wang et al., 2017).
프로바이오틱스의 EPS를 더 효율적으로 사용하기 위해 파라프로바이오틱스(paraprobiotics)란 개념이 제안되었다. 파라프로바이오틱스는 DNA, 세포막과 같이 박테리아에 필수적인 구성물을 화학적, 물리적 방법으로 파괴하여 프로바이오틱스를 생명활동이 불가능한 상태로 만든 것이다(de Almada et al., 2016). 가열을 통한 파라프로바이오틱스 생산방법은 EPS와 세포 내부 항산화 물질이 용출되도록 도와준다(Liu & Pan, 2010; Ou et al., 2011). 프로바이오틱스를 화장품 원료에 응용할 경우 제품의 pH 변화, 유효성분의 분해, 화장품 구성성분의 변화로 인해 제품성이 저하되기 때문에, 프로바이오틱스를 불활성화시킨 파라프로바이오틱스가 화장품 원료로서 더 적합하다. 동시에 파라프로바이오틱스 역시 항산화능과 항염능이 있으며, 피부에 직접 도포하여 항염작용을 얻을 수 있다는 것이 알려지며(Valdez et al., 2005), 파라프로바이오틱스의 화장품 원료로서의 기능성이 연구되기 시작했다. Lee & Kang(2020)의 논문에서는 깍두기에서 유래된 L. plantarum 사균체의 항산화능에 대한 연구가 진행되었으며, Cho & Kang(2021)의 논문에서는 김치에서 유래된 L. paracasei 사균체의 항염, 미백에 대한 연구가 진행되었다.
본 논문에서는 우리나라 각 지역의 물김치를 sampling하고, 그로부터 L. plantarum를 분리하였다. L. plantarum을 생장속도, 항산화능, 폴리페놀함량을 기준으로 screening하였다. 그리고 물김치 유래 유산균 사균체의 기능성 화장품 소재로서의 안전성을 확인하고자 항염능과 세포독성을 확인하였다. 이를 위해 Liu & Pan(2010)의 방법을 응용하여 유산균 사균체를 제조하고 다양한 방법을 통해 항산화활성과 항염활성을 확인하였다.
II. 재료 및 방법
1. Lactobacillus plantarum의 분리
본 실험에 사용한 물김치 시료는 전국에서 수집되었으며, 100개의 물김치 샘플에서 Lactobacillus plantarum을 분리하여 사용하였다. L. plantarum는 선행연구의 방법을 변형하여 분리하였다(Bujalance et al., 2006). L. plantarum selective medium의 제조방법은 다음과 같다. MRS broth(Difco, US) 55 g과 bromocresol purple 0.02 g을 증류수 1 L로 녹여 autoclave로 121°C, 15분간 멸균과정을 거친 뒤 40°C 이하로 냉각시켰다. 냉각된 배양액에 4 mg/L가 되도록 filter sterilization 과정을 거친 ciprofloxacin(TCI, Japan) 용액을 주입하여 완성한다. 백금이를 이용하여 물김치 샘플을 L. plantarum selective medium 10 mL 접종하여 37°C에서 36시간 배양하였다. L. plantarum이 배양된 경우는 pH에 의해 배양액이 노란색으로 변화한다. 노란색으로 변한 샘플을 선별하여 sucrose와 bromocresol purple을 첨가한 MRS agar에 도말하였다. 배지에 생성된 콜로니의 주변으로 노란색 환이 보이는 콜로니를 L. plantarum로서 분리하였다. 분리한 균주는 1.5 mL microtube(Axygen, USA)에 배양액 0.5 mL와 40% glycerol(Sigma, USA) 용액 0.5 mL를 혼합하여 -70°C로 설정된 deep freezer에 보관하였다. 매 실험 전 MRS broth (Difco, USA) 10 mL에 1 mL 동결보존 균체액을 접종한 뒤, 24시간 동안 37°C 혐기환경에서 전배양하여 실험에 사용하였다.
2. 증식속도
분리된 47종의 L. plantarum의 생장속도를 비교하였다. MRS broth(Difco, US) 10 mL에 분리된 유산균을 O.D(600nm) 0.7로 맞추어 0.2 mL를 접종하였다. 37°C에서 24시간 배양 후 10배 희석하여 O.D(600nm)을 측정하여 비교하였다.
3. 유산균 사균체의 제조
유산균 사균체의 제조는 Choi et al.(2006)의 방법과 Liu & Pan(2010)의 방법을 응용하여 제조하였다. 사균체의 제조과정은 증식속도에서 비교대상인 LP299v보다 높은 증식속도를 가진 균주에 대해서 실험이 진행되었다. MRS broth(Difco, USA) 200 mL에 전배양한 유산균 배양액 2 mL를 접종하여 24시간 동안 37°C 혐기환경에서 배양한 뒤, 3000 ×g(MF-300, 한일)로 원심분리하여 균체를 분리하였다. 분리된 균체는 phosphate buffered saline(PBS, pH 7.2)을 통해 세척하였다. 원심분리 및 세척은 2회 반복하여 배양액 성분을 제거하였다. 회수한 균체를 PBS로 희석하여 100°C, 30 분간 가열하여 열처리 사균체를 제조하였다. 제조된 사균체는 동결건조를 통해 분말화시켜 100 mg dry cell/mL로 희석하여 121°C, 15분간 재가열하여 사균체액으로 사용하였다.
4. 1,1-Diphenyl-2-picrylhydrazyl(DPPH) radical scavenging activity 측정
DPPH radical 소거능 실험은 Liu et al.(2011)의 방법을 응용하여 실험하였다. ‘유산균 사균체의 제조’ 방법으로 제조된 사균체를 1 mg dry cell/mL로 희석하여 실험하였다. DPPH는 1 mM DPPH(Sigma, USA)를 95% ethanol에 녹인 뒤, 실험 직전 희석 및 DPPH 시약을 첨가하여 OD517nm(Ultrospec 3100 pro, UK)가 1.000±0.100이 되도록 조정하여 사용하였다.
DPPH 용액 2.0 mL와 균체액 0.5 mL를 혼합하여 실온에서 20분 간 암실에서 1차 반응을 진행하였다. 1차 반응을 끝내고 3000 ×g로 10분간 원심분리 및 2차 반응을 진행시켰다. 원심분리 및 2차 반응이 종료되면 상층액을 분리하여, OD517nm를 측정하였다. Blank는 PBS를 이용하여 진행하였으며, DPPH radical 소거능의 계산은 다음과 같이 계산하였다.
이때 OD517nm of blank의 수치는 0.8로 하였다.
5. 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) radical scavenging activity 측정
ABTS radical 소거능 실험은 Wang et al.(2017)의 방법을 응용하여 실험하였다. ‘유산균 사균체의 제조’ 방법으로 제조된 사균체를 1 mg dry cell/mL로 희석하여 실험하였다. ABTS는 7 mM ABT S(Sigma, USA)를 2.45 mM potassium persulfate(Sigma, USA) 수용액에 녹인 뒤 16 시간동안 실온 암실에 두어 반응을 유도하였다. 그 후 실험 직전 PBS로 희석하여 OD734nm(Ultrospec 3100 pro, UK)가 1.000±0.100이 되도록 조정하여 사용하였다.
ABTS 용액 2.0 mL와 균체액 0.5 mL를 혼합하여 실온에서 10분 간 암실에서 1차 반응을 진행하였다. 1차 반응을 끝내고 3000 ×g로 10분간 원심분리 및 2차 반응을 진행시켰다. 원심분리 및 2차 반응이 종료되면 상층액을 분리하여, OD734nm를 측정하였다. Blank는 PBS를 이용하여 진행하였으며, ABTS radical 소거능의 계산은 다음과 같이 계산하였다.
이때 OD734nm of blank의 수치는 0.8로 하였다.
6. Nitrite radical scavenging activity 측정
The nitrite radical scavenging activity 실험은 Choi et al.(2008)의 방법을 응용하여 실험하였다. ‘유산균 사균체의 제조’ 방법으로 제조된 사균체를 1 mg dry cell/mL로 희석하여 실험하였다. Griess reagent는 5% phosphoric acid(TCI, Japan) 용액에 1% sulfanilamide(TCI, Japan)를 녹인 용액 A와 0.1% naphthylethylenediamine dihydrochloride(TCI, Japan) 용액을 혼합하여 제조하였다.
사균체액 1 mL와 1 mM NaNO2(Sigma, USA) 용액 1mL를 혼합한 뒤 pH 3의 0.2 M citrate buffer(Junsei, Japan) 8 mL를 넣어 혼합하였다. 그 후 용액을 37°C에서 1시간 동안 반응시켰다. 반응이 끝나면 반응이 끝난 용액 1 mL와 2% acetic acid 용액 2 mL, Griess reagent 0.4 mL를 반응시켰다. 그 후 잘 혼합하여 실온에서 15분간 반응시킨 뒤 OD520nm를 측정한다. NO radical 소거능의 계산은 다음과 같이 계산하였다.
7. Total phenolic contents 측정
Total phenolic contents 측정 실험은 Bajpai et al.(2013)의 방법을 응용하여 실험하였다. ‘유산균 사균체의 제조’ 방법으로 제조된 사균체를 1 mg dry cell/mL로 희석하여 실험하였다.
5% Folin-Ciocalteu reagent(Sigma, USA)용액 1.0 mL와 균체액 1.0 mL를 혼합하여 25°C에서 5분 간 암실에서 반응을 진행하였다. 반응을 끝내고 20% Na2CO3(Sigma, USA) 2.0 mL를 첨가하고 15 분간 반응 후, 3000 ×g로 5 분간 원심분리를 진행시켰다. 원심분리가 종료되면 상층액을 분리하여 OD730nm를 측정하였다. Gallic acid를 기준으로 standard curve를 작성하여 total phenolic content 함량을 계산하였다.
8. 세포 독성 실험
세포 독성 실험에는 RAW 264.7 cell line(한국세포주은행, 한국)을 사용하였다. 세포 배양에 사용된 배양액은 Dulbecco's Modified Eagle Medium(DMEM, GE healthcare, USA), fetal bovine serum(FBS, Sigma, USA), penicillin-streptomycin solution(Sigma, USA)를 사용하였다. DMEM 445 mL, FBS 50 mL, penicillin-streptomycin solution 5 mL를 혼합하여 배양액을 제조하였다. 사균체 배양액은 DMEM용액을 용매로 하여 1 mg/mL 농도로 제조하였다.
세포독성실험은 MTT assay를 이용하여 측정하였다. 96 well plate에 각 well 당 3.0×104 cell을 seeding하여 1일간 37°C, 5% CO2조건에서 세포를 배양하였다. 배양 후 상층액을 회수한 뒤 DMEM 배지 0.180 mL와 사균체 배양액을 0.020 mL 주입하여 다시 2일간 배양하였다. 배양 후 사균체 배양액을 회수한 뒤 MTT solution을 0.100 mL씩 처리하여 4시간 동안 결정화시켰다. 그 후 MTT solution을 다시 제거한 뒤, DMSO 0.100 mL를 처리하여 결정화된 MT T를 다시 용해시켜, 560 nm 흡광도를 통해 결정화된 MT T의 양을 측정하였다. MTT의 결정 생성은 NADH의 양과 비례하며, 생존한 세포수에 비례한다.
세포독성의 계산은 다음과 같이 계산하였다.
9. Nitric oxide 생성 측정
Nitric oxide(NO) 생성 억제능 실험에는 RAW 264.7 cell을 사용하였다. 세포 배양에는 DMEM, FBS, penicillin-streptomycin solution을 사용하였으며, 염증반응을 유도하기 위하여 lipopolysaccharide(Sigma, USA)를 사용하였다. Nitric oxide 생성 억제능은 griess reagent를 이용하여 측정하였다. Griess reagent는 1% sulfanilamide(TCI, Japan)를 5% phosphoric acid(Junsei, Japan)에 녹인 것과 0.1% naphthylethylene diamine dihydrochloride(TCI, Japan) 수용액을 1:1 비율로 혼합한 것을 사용하였다. DMEM 445 mL, FBS 50 mL, antibiotics 5 mL을 혼합하여 배양액을 제조하였다. 사균체 배양액은 DMEM용액을 용매로 하여 1 mg/mL 농도로 제조하였다.
96 well plate에 각 well 당 5.0×104 cell을 seeding하여 1일간 37°C, 5% CO2조건에서 세포를 배양하였다. 배양 후 상층액을 회수한 뒤 LPS가 1 μg/mL 농도로 첨가된 DMEM 배지 0.180 mL와 사균체 배양액을 0.020 mL 주입하여 다시 2일간 배양하였다. 배양 후 사균체 배양액의 상층액 0.100 mL을 회수한 뒤 griess reagent을 0.100 mL씩 처리하여 15분간 동안 반응시켰다. 그 후 540 nm 흡광도를 측정하였다. 540 nm 흡광도는 생성된 NO의 양과 비례한다.
Nitric oxide 생성 억제능의 계산은 다음과 같이 계산하였다.
10. 통계
모든 실험은 동일조건에서 독립적으로 3회 반복하여 Minitab® 16.1.1(IBM, USA)을 통해 평균, 표준편차를 계산하여 평균±표준편차(Mean±SD)로 표기하였으며, ANOVA method로 유의성 검증 후 Fisher's LSD method를 통해 사후검정을 실시하여, grouping 결과가 L. rhamnosus KCTC 5033과 다른 그룹에 속하는 strain을 선별하였다.
III. 결과 및 고찰
1. 증식속도
유산균의 산업화에는 대량생산을 위해 발효 수율 및 생리활성 물질의 생산 수율이 필요하며, 이는 유산균 종류에 따라 달라질 수 있어 다양한 환경에서 분리된 유산균에 대한 이들의 검토가 필요하다. L. plantarum은 식물의 표면에서 많이 분리되므로 유산균보다는 젖산균으로 부르는 경향이 있다. L. plantarum의 분리과정으로 100개 물김치 샘플에서 41개의 L. plantarum을 분리할 수 있었다. 균 증식속도의 비교는 산업적으로 가장 널리 쓰이는 L. plantarum인 LP299v와 비교하였다. Table 1은 분리된 유산균을 24시간 배양한 후 OD600nm을 측정한 것으로 24시간 배양 결과 총 7개의 균주(P23, P39, P74, P90, P91, P100, P116)가 LP299v보다 빠른 증식속도를 보였다. 그 중에서도 P116의 증식속도가 1.087로 가장 빨랐다.
증식속도가 빠른 미생물의 선별은 산업적인 측면에서 생산성 측면에서 기본 조건이라 할 수 있을 정도로 매우 중요하다. 따라서 이미 장 건강 기능성 제품 생산에 이용하는 L. plantarum인 LP299v와 비교하였고, 7개의 균주가 L. plantarum LP299v 이상의 증식속도를 보여, 산업적으로 증식속도 면에서는 1차적으로 이용가치가 있다고 볼 수 있다. 이러한 이유로 이후는 증식속도가 LP299v보다 빠른 7개의 균주를 실험에 사용하였다. 또한 항생제내성 균주를 screening하기 위하여 ciprofloxacin 함유 배지에서 배양하여, 이들 균주들은 모두 ciprofloxacin 항생제 내성을 갖는 균들이다.
2. DPPH radical scavenging activity
DPPH는 분자 한 가운데의 질소 원자가 라디칼 상태일 경우 보라색, 라디칼 상태가 아닐 경우 노란색으로 변하며, 이에 따라 520 nm 파장의 흡광도가 감소하며, 식물 추출물에서 가장 흔하게 사용되는 항산화능 평가 방법이다(Chen et al., 2005). DPPH는 주로 ethanol 및 methanol에 녹으며, 용매로서 alcohol/water를 사용한다(Sharma & Bhat, 2009). 하지만 많은 단백질이 포함된 시료의 경우 alcohol에 의해 침전물이 생성되기 때문에 항산화능 측정에 주의를 기울여야한다(Kedare & Singh, 2011).
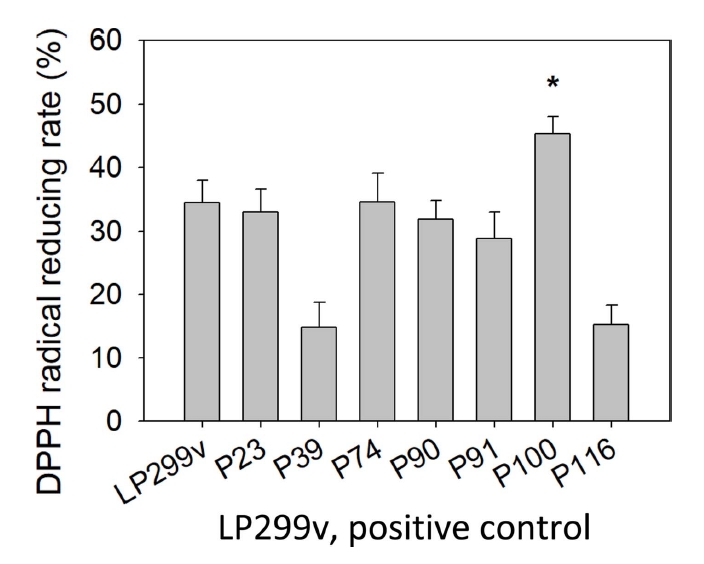
물김치에서 분리된 젖산균 중 대조군 LP299v에 비해 성장속도가 빨랐던 7개의 선발 젖산균에 대하여 DPPH radical 소거능을 실험하였고, 측정한 결과는 Table 2, Fig. 1과 같다. 실험 결과 7개의 선발 젖산균 중 대조군 LP299v의 소거능 34.43±3.52%에 비해 P74, P100이 높게 측정되었다. P74, P100의 radical reducing rate는 각각 34.57±4.57%, 45.29±2.71%로 DPPH radical 소거활성능을 보였으며, 이 중 가장 높은 소거능을 보인 P100는 대조군에 비해 10.86% 증가하여 유의적인 차이를 보였다(p<.05).
유산균은 내부에는 tocopherol, glutathione 등과 같은 항산화 물질을 생산한다. 동시에 유산균의 표면은 exopolysaccharide(EPS)라는 강력한 항산화 물질을 포함하고 있다(Zhang et al., 2013; Li et al., 2014). 김치 유산균에 관한 선행논문을 살펴보았을 때, Lim(2010)에 따르면 갓김치로부터 분리된 Lactobacillus acidophilus, Lactobacillus brevis, Lactobacillus paracasei, L. plantarum, Leuconostoc mesenteroides의 DPPH 라디칼 소거능을 측정한 결과, L. plantarum이 가장 높은 DPPH 라디칼 소거능 70.8±10.1%을 나타내었다. 이는 본 실험의 사균체 20 mg/mL 농도 조건으로 환산했을 때는 35.4%이다. 또한 Jang(2018)의 김치 유산균에 관한 실험에서도 L. mesenteroides, L. rhamnosus, L. plantarum 3종의 DPPH 라디칼 소거능을 측정한 결과, L. plantarum이 가장 높은 DPPH 라디칼 소거능 71.1%을 나타내었으며, 본 실험의 사균체 20 mg/mL 농도 조건으로 환산했을 때는 35.6%이다. Lee et al.(2016)의 김치에서 분리한 4종의 L. plantarum의 DPPH 라디칼 소거 활성을 측정한 결과, 가장 높은 수치를 나타낸 L. plantarum은 62.8±2.8%의 DPPH 라디칼 소거 활성을 나타내었다. 이를 본 실험의 사균체 20 mg/mL 농도 조건으로 환산했을 때는 33.4%이다.
이러한 선행논문의 결과는 유산균은 전반적으로 DPPH 라디칼 소거능을 가지고 있으며, 그 중 김치에서 분리한 L. plantraum이 가장 높은 소거능을 보였으며, 본 실험의 라디칼 소거능이 높은 P100과 비교하였을 때, 같은 실험조건으로 환산 시 Lim(2010)의 것보다 9.89%, Jang(2018)의 것보다 9.69%, Lee et al.(2016)의 것보다 13.89% 더 높은 소거능을 보였다.
이와 같은 결과로 물김치에서 분리한 L. plantraum P100의 사균체가 높은 DPPH radical 소거능을 보여주는 것을 알 수 있으며, 화장품의 항산화제로서 활용 가능성을 알 수 있었다.
3. ABTS radical scavenging activity
ABTS [2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)]는 비교적 안정한 free radical로서 DPPH 라디칼과 함께 식품에서의 항산화활성을 측정하는데 많이 이용한다. ABTS 측정의 경우, 산화제 용액과 ABT S 용액을 혼합시켜 ABT S를 라디칼 상태로 만든 후 사용하게 된다. ABTS가 라디칼 상태인 경우 청록색이 되며, 항산화 물질에 의해 환원되면 무색으로 탈색된다. 이를 흡광도로 나타내어 항산화 활성을 확인할 수 있는 방법이다. 파장 645 nm, 734 nm 및 815 nm에서의 흡수 최대치를 가지며, 415 nm에서의 측정값을 일반적으로 사용한다(Li et al., 2014; Re et al., 1999). ABTS radical 소거능을 측정하는 방법은 hydrogen donating antioxidant와 chain breaking antioxidant를 측정할 수 있어 hydrophilicity에 관계없이 적용이 가능하여 더 DPPH보다 민감하게 판단할 수 있다. 특히 용매로 물을 사용하기 때문에, 혈장과 같이 많은 단백질이 포함된 시료의 항산화능 측정이 가능하다(Kambayashi et al., 2009).
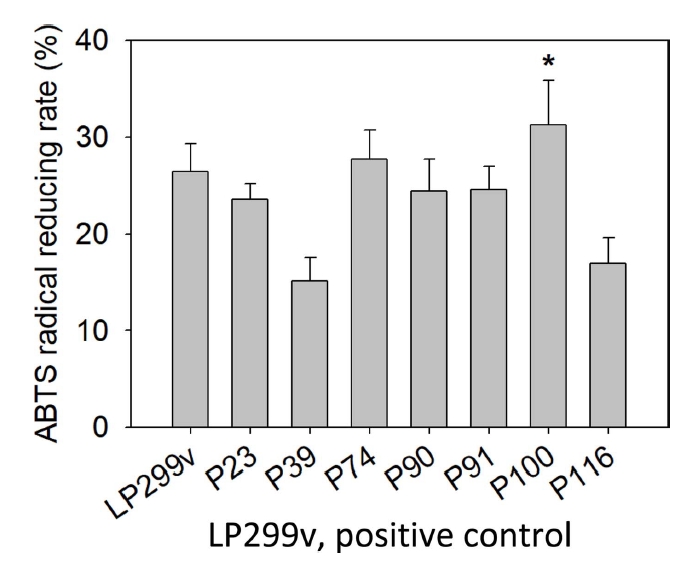
물김치에서 분리된 유산균 중 대조군 LP299v에 비해 성장속도가 빨랐던 7개의 선발 유산균에 대하여 ABTS radical 소거능을 실험하였고, 측정한 결과는 Table 3, Fig. 2와 같다. 실험 결과 7개 선발 유산균 중 대조군 LP299v의 소거능 26.43±2.86%에 비해 P74, P100이 높은 값을 나타내었다. 그리고 P74, P100의 radical reducing rate는 각각 27.71±3.00%, 31.29±2.23%로 ABTS radical 소거활성능을 보였다. 이 중 가장 높은 소거능을 보인 P100은 대조군에 비해 4.86%가 증가한 결과를 보였다(p<.05).
김치 유래 L. plantarum에 관한 선행논문을 살펴보았을 때, Yang et al.(2019)은 양배추에서 분리한 L. plantarum의 ABT S 라디칼 소거 활성을 측정한 결과 38.13±0.10%로 높은 ABT S 라디칼 소거 활성을 가지는 것으로 나타났다(Yang et al., 2019). 이는 본 실험의 사균체 20 mg/mL 농도 조건으로 환산했을 때는 17.5%이다. Jang et al.(2018)은 김치에서 분리한 L. plantarum을 가열로 사멸시켜 만들어낸 사균체의 ABTS 라디칼 소거 활성은 70.18%로 ABTS 라디칼 소거능을 나타냈었다(Jang et al., 2018). 이는 본 실험의 사균체 20 mg/mL 농도 조건으로 환산했을 때는 30.09%이다. 이러한 선행논문의 결과는 유산균은 전반적으로 ABT S 라디칼 소거능을 가지고 있었다. 본 실험의 ABTS 라디칼 소거 활성에서 가장 높은 소거능을 나타내는 P100은 Yang et al.(2019) 균보다는 13.79% 더 높은 소거활성 결과를 보였고, Jang et al.(2018)의 균보다 1.20% 높은 소거활성 결과를 보였다.
본 실험에서는 대조군과 선발 유산균은 ABT S 라디칼 소거 활성이 DPPH 라디칼 소거활성보다 비교적 낮은 수치의 결과를 나타내었다. 두 측정법은 자유 라디칼을 소거하는 정도를 측정하여 항산화능을 측정할 수 있다는 공통점이 있지만, 항산화 물질의 종류에 따라 ABT S 라디칼과 DPPH 라디칼 소거능이 다르게 나타나기 때문이다(Wang et al., 1998).
이와 같은 결과로 물김치에서 분리한 L. plantraum P100의 사균체가 높은 ABTS radical 소거능을 보여주는 것을 알 수 있으며, 화장품의 항산화제로서 활용 가능성이 있음을 알 수 있었다.
4. Nitrite radical scavenging activity
Nitric oxide(NO)는 free radical 중 reactive nitrogen species(RNS)로, NO는 inducible nitric oxide synthase(iNOS)를 통해 생성된다(Tsai et al., 2007). NO는 적정 농도에서 신경의 신호전달, 혈관 확장, 항균, 항암효과를 지닌다(Bhaskar & Balakrishnan, 2009). 하지만 만성적으로 NO에 노출될 경우 ROS와 반응하여 독성이 높은 ONOO−가 생성될 가능성이 높아지며, 이는 암 발생에도 연관이 있다(Amaeze et al., 2011). NO 역시 ROS와 동일하게 항산화물질에 의해 소거되지만(Lakhanpal & Rai, 2007) 항산화 물질의 구조와 특징에 따라 radical 소거능에 차이가 존재한다(Kang et al., 1996).
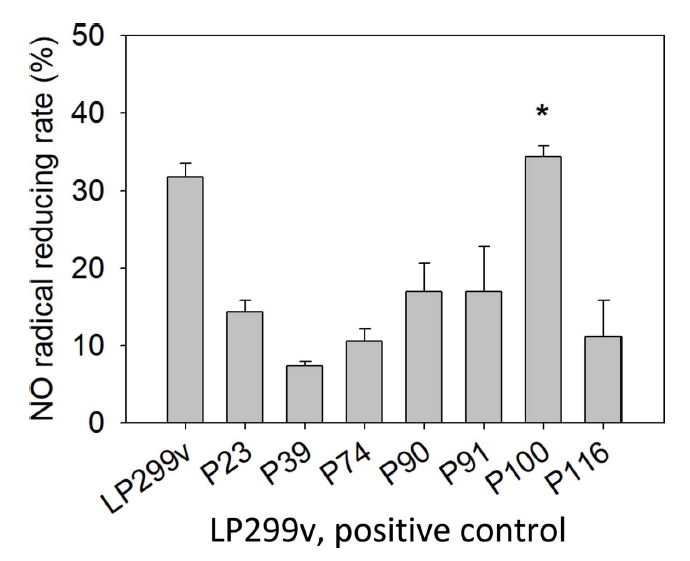
물김치에서 분리된 유산균 중 대조군 LP299v에 비해 성장속도가 빨랐던 7개의 선발 유산균에 대하여 NO radical 소거능을 실험하였고, 측정한 결과는 Table 4, Fig. 3과 같다. 실험 결과 7개의 선발 유산균 중 대조군 LP299v의 소거능 31.75±2.21%에 비해 P100이 높은 값을 나타내었다. P100의 radical reducing rate는 35.40±1.35%로 NO radical 소거활성능을 보였다. 가장 높은 소거능을 보인 P100은 대조군에 비해 3.65%가 증가한 결과이다(p<.05).
Seo et al.(2015)은 L. plantarum 사균체의 NO radical 소거능은 29.72%를 보였다고 보고하였다. Bajpai et al.(2016)은 Lactobacillus sakei의 NO radical 소거능은 16.22%를 보였다고 보고하였다. 본 실험에서 분리한 P100의 NO radical 소거능은 L. plantarum 사균체를 연구한 선행연구(Seo et al., 2015)에서 발표된 NO radical 소거능보다 5.68% 뛰어났다. 동시에 L. sakei 사균체를 연구한 선행연구(Bajpai et al., 2016)에서 발표된 NO radical 소거능보다 약 2배 뛰어났다.
이와 같은 결과로 본 연구의 물김치 유산균의 사균체는 높은 nitrite radical scavenging activity을 보여주는 것으로 보인다.
5. Total phenolic contents
Total phenolic contents 실험에 사용되는 Folin-Ciocalteu reagent에는 phosphomolybdate/phosphotungstic acid complex가 포함되어 있다. Phenolic compound는 알칼리조건에서 phosphomolybdate/phosphotungstic acid complex에 전자를 공여하여 청자색의 환원물을 생성한다(Hong et al., 2011). 하지만 phenolic compound 이외에도 단백질, 핵산, 환원당, thiol성 물질, amine 성 물질들 역시 전자공여능으로 인해 측정에 영향을 준다. 고순도로 정제한 EPS에서도 phenolic compound가 측정된다(Wang et al., 2016). Phenolic compound는 단백질 또는 효소 등의 기타 거대분자들과 수소를 공유하며 결합하는 성질을 가지고 있어, 라디칼 포착 활성뿐 아니라 강한 환원력과 금속킬레이트 작용을 지니고 있는 항산화물질이다. 이러한 특성으로 phenolic compound는 피부암의 치유와 예방, 항균, 항알레르기 및 항암효과에 관여하는 것으로 알려져 있고, 또한 활성산소의 효과적인 제거로 노화 억제의 기능이 있는 것이 보고되었다(Behera et al., 2018; Chabance et al., 1998; Ryu, 2000; Kang, 2015).
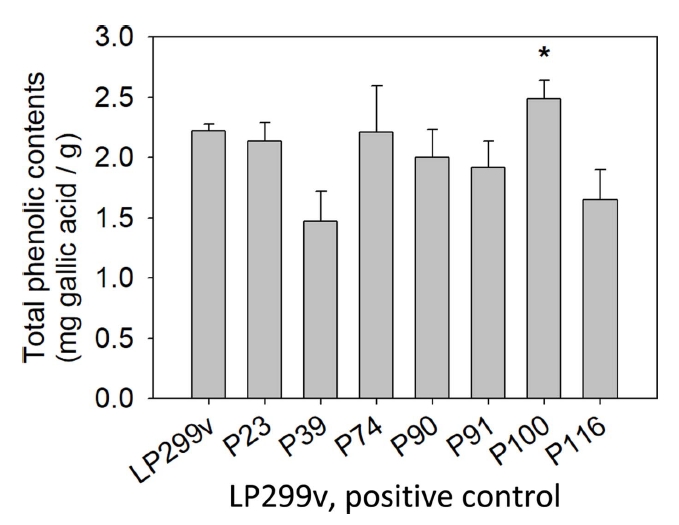
물김치에서 분리한 유산균 중 대조군 LP299v에 비해 성장속도가 빨랐던 7개의 선발 유산균에 대하여 total phenolic compound 함량을 실험하였고, 측정한 결과는 Table 5, Fig. 4와 같다. 실험 결과 7개 균 중 대조군 LP299v의 22.21±0.62 mg gallic acid/g에 비해 1개의 균이 폴리페놀 함량이 높게 측정되었다. P100은 각각 24.85±0.143 mg gallic acid/g으로, 대조군에 비해 2.64 mg gallic acid/g 더 높은 폴리페놀 함량을 나타내었다(p<.05).
본 실험은 배양 후 세척한 균체만을 가지고 실험한 것이므로 균체 자체가 가지고 있는 폴리페놀을 측정한 것이다. 이와 같은 실험 방법으로 Seo et al.(2015)은 L. plantarum 사균체의 phenolic contents는 18.96 µg/mg이라고 보고하였다. Bajpai et al.(2016)은 L. sakei의 phenolic contents는 20.38 µg/mg이라고 보고하였다. 물김치에서 분리한 L. plantraum P100의 사균체는 Seo et al.(2015)의 것보다 5.89 mg gallic acid/g 높은 함량을 나타내었다. 그리고 Bajpai et al.(2016)의 것보다 4.47 mg gallic acid/g 높은 함량을 나타내었다. 폴리페놀 함량이 증가할수록 항산화 등의 생리활성이 증가하는 경향으로 보고되어 있어(Ryu, 2000; Imai et al., 1994), P100은 기능성화장품 소재로서의 가능성을 보이는 결과라고 사료된다.
6. 항산화 활성이 뛰어난 균주 선별과 동정
기존 화장품은 주로 화학적 합성물을 기반하여 만들었다. 하지만 최근 ‘그린슈머’ 트렌드에 맞추어 화장품의 생산부터 기능성 확인까지 친환경적 과정을 통해 만들어진 화장품을 선호하는 경향이 안착되었다. 이에 유산균은 이러한 트렌드에 적합한 화장품 원료로서 각광받고 있다(Ferreira et al., 2017).
초기 유산균을 이용한 화장품은 유산균을 이용한 발효가 대부분이었으나(Izawa & Sone, 2014), 현재 유산균을 화장품원료로 이용하는 방법으로 유산균 배양산물을 이용하는 방법과 유산균 균체를 이용하는 방법이 있다. 유산균 대사산물을 이용하는 방법으로는 유산균 생산 계면활성제(biosurfactant)(Gudina et al., 2010; Ferreira et al., 2017), 유산균 생산 항균물질로 bacteriocin (Gudiña et al., 2010), 유산균 배양액(Lactobacillus spent culture supernatant) (Tsai et al., 2013)을 이용하는 방법이 있다. 한편 유산균 균체를 이용한 방법으로는 whole cell lysate(Kim et al., 2020)를 사용하거나, EPS(Li et al., 2020), LTA(Kim et al., 2015) 등을 추출하여 사용하는 방법이 있다.
본 논문에서는 화장품 원료로서 적합한 유산균을 분리하기 위하여 생산성과 기능성을 기준으로 균을 분리하였다. 유산균 중 가장 산업적으로 널리 사용되는 유산균인 L. plantarum의 균을 분리하기 위해 생장속도, ciprofloxacin 내성, 산소 요구성 등을 이용하였다. 대조군으로 기능성의 기준으로서 가장 산업적으로 가장 널리 사용되는 LP299v를 사용하였다.
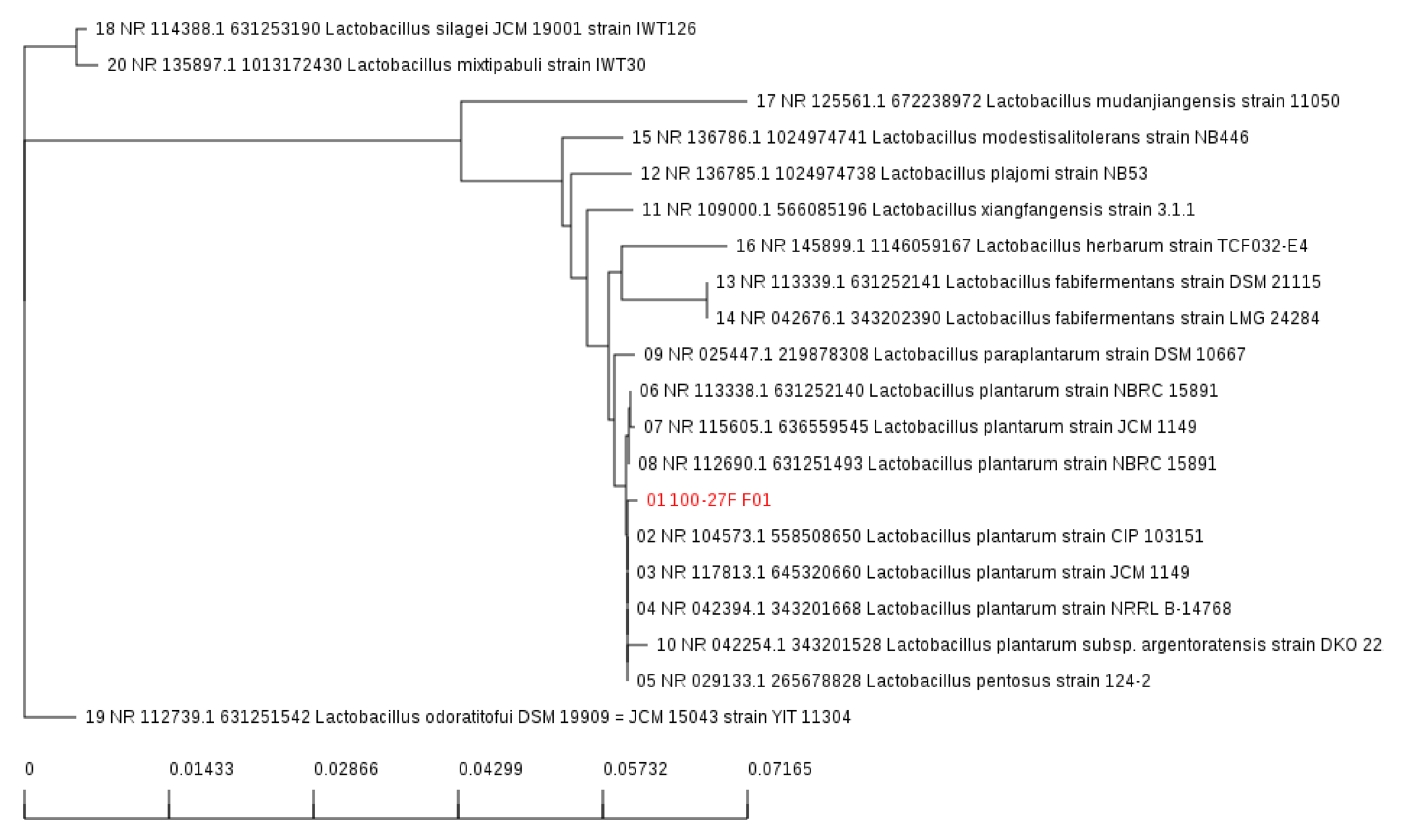
LP299v와 비교하여 우수한 항산화능을 보이는 균주를 찾기 위해 DPPH assay, ABTS assay, NO scavenging activity assay, total phenolic contents를 실시하였으며, 모든 실험에서 LP299v 보다 우수한 L. plantarum P100을 분리하였다. 분리된 균은 16S rRNA 분석을 통해 L. plantarum 임을 확인하였다(Fig. 5). 본 실험에서 사용된 여러 가지 항산화능 실험은 L. plantarum P100의 사균체를 이용한 것이며. EPS 및 cytoplasmic contents의 활성을 본 것이라 할 수 있다.
사균체 유산균의 주된 항산화 물질은 EPS로 알려져 있으며, 항산화활성은 EPS 생산량 차이에 의한 것으로 판단된다. 유산균은 eps gene의 유무에 따라 EPS의 생산량이 달라지며, 해당 gene은 Escherichia coli의 glycosyltransferase gene인 wzx gene과 sequence와 역할이 유사하다(Jolly & Stingele, 2001). 즉 본 실험에서 유산균 간 차이를 보인 이유는 해당 gene의 유무가 크게 관여하고 있을 것으로 보인다. 유산균은 동물의 내장, 식물 표면, 유제품 등에서 널리 발견되며, 실험에 따라 최대 EPS 생산량을 보이는 종은 L. plantarum, L. casei, L. rhamnosus 등 다양하다(Ruas-Madiedo et al., 2007; Dupont et al., 2000).
본 논문에서는 L. plantarum LP299v보다 뛰어난 L. plantarum 균주를 분리하는 것을 목표로 하였으며, L. plantarum P100이 L. plantarum LP299v보다 더 높은 항산화성을 보여 항산화성이 높은 균주로 나타났다. 따라서 이 균의 사균체를 이용하여 화장품 원료로 사용할 수 있는 것으로 보인다.
7. Cell toxicity and Anti-inflammatory activity
MTT assay는 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide가 mitochondrial reductase에 의해 비수용성인 formazan으로 환원되어 결정체를 만드는 특징을 이용하는 것으로, mitochondrial reductase의 양은 살아있는 mitochondria의 수와 정비례한다(Mosmann, 1983). 뿐만 아니라 세포의 NAD(P)H-dependent oxidoreductase enzyme의 활성과도 비례적으로 작용하기 때문에 생존 세포의 활성과도 관련이 있다(Lim et al., 2020).
Raw 264.7에 대한 MTT assay 결과는 Table 6과 Fig. 6과 같다. MTT assay 결과, L. paracasei 14-1의 1개 strain이 대조군보다 높은 세포독성을 갖는 것으로 나타났다. 그 중 가장 낮은 세포독성을 보인 균주는 P100으로 1.73%의 세포독성을 나타내었다. T-test 결과, P39와 P100을 제외한 5개 strain에서 통계적으로 유의미한 수준의 세포독성이 나타났다.
NO는 생체 내에서 면역반응을 조절하는 인자로 알려져 있다(Erkan et al., 2002). 하지만 만성적이며 과도한 NO는 심한 염증을 유도하여 세포의 손상을 일으킨다(Grisham et al., 2002; Sharma et al., 2007). 이를 위해서 non-steroidal anti-inflammatory drugs의 대부분은 NO의 생산을 조절하여 염증으로 인한 세포의 손상과 그로 인한 질병을 방지한다(Sharma et al., 2007).
사균체를 처리한 RAW 264.7의 NO 생성량은 Table 7과 Fig. 7와 같다. 실험 결과, P90을 제외한 모든 strain이 대조군에 비해 NO 생성량이 적은 것으로 나타나났다. 그 중 가장 높은 생성 억제량을 나타낸 균주는 P100으로 22.32%의 NO 생성 억제능을 보였다. T-test 결과, P100이 통계적으로 유의미한 수준으로 NO 생성 억제능을 보였다.
IV. 결 론
최근 유산균은 건강보조식품뿐만 아니라 이너 뷰티 제품으로 활용되고 있다. 본 연구에서는 채소를 주 원료로 한 발효식품인 물김치에서 유산균 L. plantarum을 분리하였다. 41개의 L. plantarum 중 성장속도가 빨랐던 7종을 선발하여 사균체로 만든 후, 산업적으로 많이 사용하고 있는 L. plantarum LP299v을 대조군으로 하여 항산화활성을 비교하여, 새로운 젖산균 사균체 화장품 소재 물질로의 사용 가능성을 검토하였다.
DPPH radical 소거활성은 L. plantarum P100이 45.29±2.71%로 가장 높았으며, 대조군에 비해 10.86% 높았다(p<.05). ABTS radical 소거활성은 L. plantarum P100이 31.29±2.23%로 가장 높았으며, 대조군에 비해 4.86% 높았다(p<.05). NO 소거활성은 L. plantarum P100이 31.75±2.21%로 가장 높았으며, 대조군에 비해 3.65% 높았다(p<.05). 총 폴리페놀 함량은 L. plantarum P100이 24.85±0.143 mg gallic acid/g로 가장 높았으며, 대조군에 비해 2.64 mg gallic acid/g 높았다(p<.05).
따라서 L. plantarum P100는 대조군 LP299v보다 DPPH radical 소거활성은 10.86%, ABTS radical 소거활성은 4.86% 더 높았으며, 총 폴리페놀 함량은 10.62% 더 많았다. 그리고 NO 소거활성은 대조군에 비해 3.65% 높았다. L. plantarum 7종 중 L. plantarum P100가 모든 항산화능 측정 실험에서 우수한 항산화 효과를 나타나내었으며, 새로운 젖산균 사균체 화장품 소재 물질로의 사용 가능성을 보였다. 이를 바탕으로 L. plantarum P100이 L. plantarum LP299v보다 더 많은 항산화 물질을 함유하고 있는 것으로 보이며, 이 균의 사균체를 이용하여 화장품 원료로 사용할 수 있을 것으로 보인다.
한편 화장품으로서 안전성을 확인하기 위해서 유산균 사균체의 세포 독성 및 항염평가를 진행하였다. 세포독성이 낮은 균주로는 P39와 P100을 선정하였으며, 항염능이 높은 균주로는 P100을 선정하였다. 이를 바탕으로 추가적인 세포실험을 통해 L. plantarum P100 균주의 화장품 원료로서의 특성 연구가 더 필요할 것으로 보인다.