홍경천 뿌리 분획물의 기능성화장품 원료로서의 평가
Evaluation of Rhodiola rosea Root Fraction as a Functional Cosmetic Ingredient
Article information
Trans Abstract
To develop functional cosmetic material using Rhodiola rosea, the biological activities such as anti-oxidant, anti-inflammatory, astringent, anti-tyrosinase, and anti-elastase activity were investigated with methanol, n-hexane, chloroform, ethyl acetate, n-butanol, and water fractions of R. rosea Root. DPPH and ABTS radical scavenging activities of ethyl acetate fraction were increased in a dose-dependent manner; the activities were higher than other fractions. The total phenolic content of ethyl acetate fraction also showed a relatively high value of 500.485±4.848 mgGAE/g. The ethyl acetate fraction also significantly decreased LPS-induced NO production and IL-6 secretion compared with untreated control cells at above 5-100 μg/mL concentrations. The astringent activity of ethyl acetate fraction was 94.31% at a concentration of 500 μg/mL, and the activity of ethyl acetate fraction was similar to that of tannic acid. The mushroom tyrosinase inhibition abilities of hexane, ethyl acetate, and butanol were 10.44%, 17.53%, and 14.55%, respectively, at 100 μg/mL. Furthermore, an elastase inhibition rate showed a relatively high effect at 100 μg/mL, 45.46% of inhibition rate in the ethyl acetate and 45.07% of inhibition rate in the butanol fraction. These results indicate that R. rosea Root would be used as a natural material in the functional cosmetic and beauty-food industries.
I. 서 론
피부 노화는 자연적 노화 현상에 의한 탄력 저하뿐만 아니라 수면부족과 스트레스, UVA나 UVB 및 적외선과 같은 눈에 보이지 않는 태양광선에 대한 장시간의 지속적 노출 등의 외부 자극에 의해 그 속도가 더 빠르게 진행될 수 있다. 그러나 최근 스트레스와 자외선 외에 미세먼지, 매연, 가스, 중금속 등의 독성물질을 포함한 대기오염, 밀폐된 공간, 생활 공해, 세정 및 위생 제품 등의 생활오염, 스마트폰, PC와 LED 조명 등의 청색광을 포함한 외부 스트레스 요인 증가는 세포 내 산화 스트레스를 유발하여 피부 노화를 촉진한다고 알려져 있다(Puri et al., 2017; Vierkötter, 2011). 따라서 이를 예방하고 노화의 속도를 늦추기 위한 스킨케어와 안티에이징과 관련된 천연원료 소재 개발 연구는 현대인의 생활필수품이자 근본적인 피부건강을 위한 개인 아이템으로 자리 잡은 화장품과 관련된 산업분야에서 활발히 진행되고 있다.
홍경천(紅景天, Rhodiola rosea)은 돌나물과(Crassulaceae), 돌꽃속 (Rhodiola genus)의 (Han, 1999) 여러 해 살이 식물로 아시아, 유럽 및 남아메리카에 걸쳐 약 200 여종으로 분류되며, 이 중 홍경천을 포한한 약 20여종만이 전통 약용식물로 사용되어 주목받고 있다(Brown et al., 2002; Panossian et al., 2010; Chiang et al., 2015). 홍경천 뿌리는 golden root 또는 rose root로도 불리며 피로회복, 기억력 증진, 항 저산소증에 대한 자연 치료법뿐만 아니라 심장보호, 우울증, 불안, 수명연장 및 업무 생산성 향상에 도움이 되는 것으로 밝혀져 있다(Zhuang et al., 2019). 홀리바질(Tulsi), 동충하초(Cordyceps), 영지버섯(Reishi) 등과 같이 신체적·정신적으로 다양한 스트레스 요인에 대항하는 효능의 화합물을 아답토젠(adaptogen)이라 하는데, 대표적으로 홍삼의 ginsenoside가 이에 해당한다(Kelly, 2001). 홍경천의 rosavins 성분도 Rhodiola species 중 유일하게 홍경천에서만 검출되는 대표적인 아답토젠 성분이며(Brekhman & Dardymov, 1969; Khanum et al., 2005), 이외에도 홍경천에는 풍부한 페놀산, 플라보노이드 및 탄닌을 포함한 다양한 생물학적 활성 성분이 포함되어 있어 항산화, 항 염, 항 피로, 항암, 항 미생물, 항 바이러스, 기억력 증진, 내분비조절, 면역 활성 등의 노화와 질병 치료를 위한 약리학적 효능 연구의 소재로 주목받고 있다(Ishaque et al., 2012; Li et al., 2017). 따라서 본 연구에서는 홍경천 뿌리를 대상으로 극성도에 따른 단계별 추출을 통하여 제조된 여러 가지 분획추출물을 획득하고 이를 이용하여 항산화, 항염, 수렴, 미백 및 항주름 효능을 비교 평가하여 기능성 화장품 원료로서의 가능성을 조사하고자 하였다.
II. 재료 및 방법
1. 시료 추출 및 분획
본 실험에 사용한 중국산 홍경천 뿌리는 world.taobao.com에서 건조된 것을 2022년 구매하여 분쇄(KSP-225, KOREAMEDI Co., LTD)후 사용하였다. 먼저 시료 중량 250 g에 2.5 L의 80% 메탄올을 가하여 실온에서 침지하여 상등액과 침전물을 분리하여 동일한 방법으로 3회 반복 추출하고, 이를 여과지(Whatman No. 1, Maidstone, England)로 여과 및 감압농축(EYESA, N-1100 series, Tokyo, Japan) 후 72시간 동안 동결 건조(Labconco Co., MO, USA)하여 분말을 얻었으며, 냉동보관하면서 항산화, 항 염, 수렴, 미백 및 항 주름 등의 효능 평가를 위한 시료로 사용하였다. 또한 메탄올추출물 최종 건조중량 100 g에 순서대로 각 극성이 다른 n-hexane, chloroform, ethyl acetate, n-butanol 용매를 첨가하여 분획을 실시하였으며 최종 남은 용액은 water layer로 하였다. 이들 분획물은 60oC에서 1시간 진공농축을 거쳐 동결 건조 후 냉동보관하며 실험에 사용하였다.
2. DPPH 소거활성 측정
홍경천 뿌리 메탄올추출물 또는 분획물의 라디컬 소거 효과는 메탄올 용매에 녹인 보라색의 DPPH(2,2-diphenyl-1-picrylhydrazyl, Sigma, MO, USA)가 노란색으로 변색되는 정도에 따라 시료의 전자 공여능이 결정되는 원리인 DPPH 라디컬 소거법으로 측정하였다(Blois, 1958). 각 농도별 시료와 메탄올에 녹인 0.2 M DPPH 용액을 섞고 강하게 10초간 vortex한 후 37oC에서 빛을 차단한 상태로 30분 반응시키고 흡광도(517 nm)를 측정하였다. 양성 대조 물질은 ascorbic acid(Sigma, MO, USA)를 사용하였다.
3. ABTS 소거활성 측정
홍경천 뿌리 메탄올추출물 및 분획물의 양이온 라디컬(ABTS+) 소거 효과는 청록색의 ABTS(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid))가 시료에 의해 탈색되는 정도에 따라 항 산화능을 결정하는 ABTS 라디컬 소거법을 이용하였다(Re et al., 1999). 먼저 ABTS(7 mM)와 2.45 mM의 potassium persulfate를 섞어 18 시간 동안 반응시켜 생성된 라디컬을 각 시료와 30분 혼합한 후 734 nm파장에서 흡광도를 측정하였다.
4. 총 폴리페놀 함량 측정
홍경천 뿌리 메탄올추출물 및 각 분획물 내 폴리페놀 성분 측정은 AOAC(Association of Official Agricultural Chemists)의 Folin-Denis 방법(Folin & Denis, 1912)을 이용하였으며, Folin-Ciocalteau's phenol 시약이 시료 내 페놀성 화합물에 의해 환원 시 청색으로 발색되는 원리이다. 각 시료와 Folin-Ciocalteau's phenol 용액을 5분간 섞은 후 10% sodium carbonate를 첨가하여 30분 반응시켰다. 반응액을 원심분리한 후 상등액을 취하여 550 nm 파장에서 흡광도를 측정하였으며, 표준물질 gallic acid(Sigma, MO, USA)를 사용하였다.
5. RAW264.7 세포에서 nitric oxide(NO) 측정
RAW264.7 macrophage cell을 DMEM 배지 1 mL당 0.5×105 cell로 계수하여 24 well plate의 각 well에 2 mL씩 넣고 부착되도록 24시간 배양하였다. LPS (lipopolysaccharide, 100 ng/mL)와 각 시료를 처리하고 18시간 배양 후 세포 배양액 내로 분비된 NO 양을 Griess reagent를 이용하여 정량하였다. Giress reagent와 각 시료를 혼합하고 10분간 방치한 뒤 흡광도(550 nm)를 측정하였다. 표준검량 곡선은 농도별로 제조한 NaNO2 를 이용하여 작성하였다(Yang & Lee, 2020).
6. Western blot analysis
배양된 세포의 배지를 제거하고 PBS로 2번 씻고 RIPA lysis buffer(Thermo scientific, IL, USA) 로 30분간 용해시킨 후 15,000 rpm에서 30분간 원심 분리하여 상층액을 취하였다. 단백질은 Bradford 시약을 사용하여 정량하고, 각 well당 50 ㎍의 총 단백을 SDS-PAGE에 전기영동 시켰다. Gel 내 단백질을 PVDF membrane으로 이송시키고 5% BSA solution으로 30분 간 반응시킨 후 1차 항체 항 COX2 항체, 항 MITF 항체, 항 TRP-1 항체, 항 TRP-2 항체, 항 MMP-1 항체 및 항 β-actin을 사용하였으며 2차 항체로는 항 rabbit IgG-HRP 항체와 항 mouse IgG-HRP 항체를 각각 Novus biologicals, Cell signaling, Santa cruz로부터 구매하여 사용하였다(Yang & Lee, 2022).
7. IL-6 cytokine 측정
RAW264.7 cell을 24 well plate의 한 well에 1×105 cells로 배양하여 100 ng/mL의 LPS와 각 시료로 세포에 18시간 자극하였다. 세포에서 생성된 IL-6 생성 변화 정도를 알아보기 위해 세포 배양액을 쥐의 IL-6 cytokine을 검출하는 ELISA kit를 이용하여 제조사의 protocol에 따라 수행하였다(Wei & Lee, 2022).
8. 수렴 활성 측정
홍경천 분획물의 수렴 활성을 조사하기 위해 1 mg/mL의 농도로 인산완충용액에 녹인 소의 혈액 단백질인 hemoglobin(Sigma, MO, USA)을 각 시료와 동일한 양으로 섞었다. 원심분리를 3,000 rpm에서 15분간 수행한 후 상등액을 대상으로 흡광도(407 nm)를 측정하여 탈색 변화를 비교하였다(Wunsch & Heidrich, 1936).
9. Tyrosinase 저해 활성 측정
Tyrosinase 저해활성 측정은 L-tyrosine을 기질로 하여 tyrosinase에 의해 생성되는 중간 단계인 DOPA chrome을 분광 광도계를 이용하여 측정하였다. 먼저 농도별로 희석한 시료를 L-tyrosine과 mushroom tyrosinase가 포함된 100 mM의 sodium phosphate (pH 6.5)에 첨가하고 37oC에서 20분 반응시킨 후 흡광도(475 nm)를 측정하였으며 양성 대조물질로 kojic acid (Sigma, MO, USA)를 사용하였다(Xia & Lee, 2022).
10. Elastase 억제 활성 측정
홍경천 분획물의 elastase 효소 저해 활성 측정은 neutrophil elastase colorimetric drug discovery kit를 Enzo Life Science로부터 구매하여 사용하였다. 농도별로 희석한 시료를 kit 제조사의 protocol에 따라 수행하였으며, 표준물질은 elastase 억제제인 elastatinal을 최종농도 100 μM로 사용하였다(Correia et al., 2022).
11. 통계
홍경천 뿌리 메탄올추출물과 각 분획물을 대상으로 수행한 연구 결과는 3회 반복 측정하여 평균(mean)±표준편차(standard deviation, SD)로 표시하였다. 평균값의 통계적 유의성 검정은 Student's t-test법을 이용하여 *p<0.05 이하 수준에서 판정하였다.
III. 결과 및 고찰
1. 홍경천 뿌리 메탄올추출 및 분획
식물의 생리활성 성분 추출을 위해 주로 사용되는 추출법은 유기용매와 열수를 이용하는 방법이 대표적이다. 그러나 열수 추출법이 일반적으로 식물의 생리기능성 물질 추출에 가장 많이 사용되고 있음에도 불구하고, 에너지 소비가 높으며, 고열에 의한 유용성분 파괴 등이 문제점으로 제기되고 있다(Shin & Lee, 2011; Oh et al., 201). 따라서 Fig. 1의 분획모식도와 같이 본 연구에서는 홍경천 뿌리를 대상으로 메탄올 용매로 먼저 조 추출물(crude extract)을 제조한 후, 이를 대상으로 hexane(Polarity index, PI=0.1), chloroform(PI=4.1), ethyl acetate(PI=4.4), butanol(PI=3.9) 등의 4가지 유기용매별 극성도에 따른 다양한 분획물의 효능을 비교 분석하고자 하였다(Abubakar & Haue, 2020; Lefebvre et al., 2021; Patra et al., 2022). 각 용매 hexane, chloroform, ethyl acetate, butanol 및 water를 이용한 분획별 최종 수율은 각각 0.009%, 5.0%, 6.5%, 29.8%, 46.5%로 나타나 홍경천 뿌리 내에는 비극성 용매보다 물과 극성 용매에 용출되는 성분 함량이 더 높음을 알 수 있었다(Table 1).
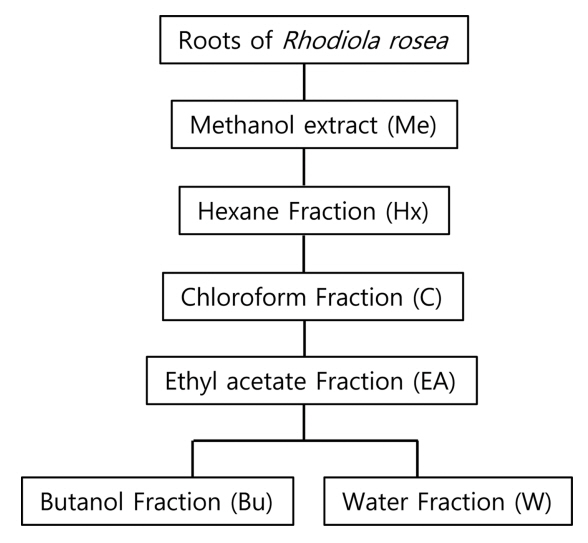
Flow chart of methanol extract and its solvent fractions from R. rosea root using hexane, chloroform, ethyl acetate, butanol, and water. Me, methanol; Hx, n-hexane; C, chloroform; EA, ethyl acetate; Bu, butanol; W, water. Data are expressed as mean±S.D. in three independent experiments.
2. 항산화 효과
홍경천 뿌리 메탄올추출물 및 분획물의 항산화 효능을 조사하기 위해 DPPH 라디컬 소거능(DPPH radical scavenging activity, DPPH RSA), ABTS 라디컬 소거능(ABTS radical scavenging activity, ABTS RSA) 및 총 폴리페놀 함량(Total polyphenol contents, TPC)을 측정하였다. DPPH 라디컬 소거능은 Fig. 2A와 같이 모든 시료 농도 10 ㎍/mL 조건에서 ethyl acetate (EA) > butanol (Bu) > hexane (Hx) > chloroform (C) > methanol (Me) > water (W)순으로 나타났으며, 특히 EA와 Bu는 대조군으로 사용된 ascorbic acid보다 높은 활성을 나타냈다. 양이온의 ABTS 라디컬 소거능은 Fig. 2B와 같이 모든 시료 농도 50 ㎍/mL 조건에서 ethyl acetate (EA) > hexane (Hx) > butanol (Bu) > chloroform (C) > methanol (Me) > water (W)순으로 나타났으며, 이 때 EA 분획물의 라디컬 소거율(62.21%)이 강력한 항산화제인 ascorbic acid (62.65%)와 유사한 값으로 가장 높게 나타났다.

Radical scavenging activity of methanol extract and its solvent fractions from R. rosea root. (A) DPPH radical scavenging activity, (B) ABTS radical scavenging activity, and (C) Calibration curve of gallic acid for determination of total polyphenol content. Me, methanol; Hx, n-hexane; C, chloroform; EA, ethyl acetate; Bu, butanol; W, water; AA, ascorbic acid; TPC, Total polyphenol content. Data are expressed as mean±S.D. in three independent experiments.
이러한 결과들은 러시아산 홍경천 뿌리 메탄올추출물과 물 추출물의 Superoxide anion 라디컬 소거능 결과 메탄올추출물이 양성대조물질인 ascorbic acid와 물 추출물보다 더 높은 소거율을 나타내고, DPPH 라디컬 소거능 결과 10 ppm 농도 조건에서 양성대조물질인 vitamin E와 유사한 소거율을 나타내어 홍경천 뿌리 ethyl acetate 분획물의 천연 항산화제로서의 가능성이 매우 높을 것으로 기대된다(Lee, 2012).
홍경천 뿌리 추출물과 5종 분획물의 총 페놀성 화합물 함량은 표준물질인 gallic acid를 농도별로 제조하여 작성한 표준곡선을 사용하여 mg gallic acid equivalent(GAE) per g으로 표기하였다(Fig. 2C). 그 결과 유기산과 탄닌 등의 폴리페놀성분 성분과 같은 약한 정도의 극성 성분이 용출되는 에틸아세테이트(EA) 분획물에서 500.48±4.84 mgGAE/g으로 다른 분획물보다 1.39배에서 7.59배로 높게 나타나 에틸아세테이트 분획물의 항산화 활성이 가장 우수함을 알 수 있었다(Table 1).
이러한 결과들은 최근 홍경천 뿌리 초임계추출물 또는 70% 메탄올추출물을 대상으로 각각 HPLC-ESI-MS/MS, UPLCQqQ-MS-based metabolomics 분석을 수행한 결과, 클로로겐산, 루테올린, 카테킨, 쿼세틴 등 생물학적으로 높은 활성의 다양한 페놀화합물이 검출되었다(Dong et al., 2020; Zakharenko et al., 2021)는 선행연구들과 더불어 항산화제로서 홍경천 뿌리 활용 시 용매 선택에 대한 기초 자료로서 가치가 있다고 사료된다.
3. 항염증 효과
홍경천 뿌리 메탄올추출물 및 분획물의 항 염 효능은 mouse macrophage cell line, RAW264.7 cell에 LPS를 처리하여 염증 반응을 유도한 후 LPS에 의한 염증 매개 물질 NO, iNOS 및 cytokine IL-6 등의 변화를 확인한 결과 Fig. 3과 같다. 세포만 배양한 무처리군(CON)에서 검출된 NO 생성량이 0.739 μM일 때, LPS 처리 후 NO 생성은 5.304 μM로 증가하였다. 이러한 염증 조건하에서 모든 시료를 농도 100 ㎍/mL 조건으로 처리 한 결과, LPS에 의해 증가된 NO 생성량은 2배 이상 감소하였으며, 특히 Hx와 C는 각각 3.6배, 3.4배로 가장 많이 억제되었다(Fig. 3A). 이는 Rabbit 동물 모델 실험결과, 감금스트레스(restraint stress)를 처치한 group의 혈액에서 증가된 NO 수준이 홍경천 뿌리 추출물 투여 후 2배 저하된 선행 연구결과와 맥을 같이 한다(Panossian et al., 2007).

Anti-inflammatory activity of methanol extract and its solvent fractions from R. rosea root. (A) NO production, (B) IL-6 cytokine secretion, and (C) COX2 protein level. CON, Control; LPS, lipopolysaccharide; Me, methanol; Hx, n-hexane; C, chloroform; EA, ethyl acetate; Bu, butanol; W, water. Data are expressed as mean±S.D. in three independent experiments. Statistical differences are presented. *p<0.05.
염증 반응 산물 중 하나인 염증성 싸이토카인 IL-6의 분비량을 ELISA 분석법을 통해 조사한 결과, Fig. 3B와 같이 LPS에 의해 급격하게 증가된 IL-6 생성량(143 pg/mL)은 각 시료 처리 후 현저하게 감소하였으며, NO 결과와 동일하게 Hx(12.5 pg/mL)와 C(17 pg/mL)의 IL-6 분비 억제 효능이 매우 우수하였다.
각 분획물이 염증 부위에서 유도되는 COX2 효소 발현에 미치는 영향을 단백질 수준에서 확인한 결과, Fig. 3C와 같이 EA 분획물 처리에 의한 COX2 단백질 발현수준이 억제됨을 확인하였다. 이러한 연구 결과는 Rat을 이용한 급성염증 model에서 홍경천 추출물(0.5 mg)에 의한 COX2 효소 활성 저해가 양성대조군인 aspirin과 유사한 값을 나타냈다고 보고한 선행연구 결과와 종합하여 볼 때(Bawa & Khanum, 2009), 홍경천은 COX2의 단백질 발현뿐만 아니라 효소 활성을 억제함으로써 우수한 항염제 후보물질로서의 가능성이 있음을 시사한다.
4. 수렴 효과
홍경천 뿌리의 강한 쓴 맛은 탄닌 성분에 기인한 것으로 성분 분석 연구에 의해 보고되었으며(Dong et al., 2020), 건강식품 시장에서 홍경천 식품 개발과 활용을 높이기 위해 쓴 맛 제거를 위한 다양한 추출법 연구가 진행되고 있다(Zhao et al., 2019). 그러나 미용학적으로 홍경천 뿌리 내에 함유되어 있는 폴리페놀 중 하나인 탄닌 성분에 의한 피부 수렴제로서 활용 가능성을 조사하고자 홍경천 뿌리의 각 분획물을 농도별로 제조하여 수렴 활성을 적혈구 침전법으로 수행한 결과는 Fig. 4와 같다. 각 분획물의 농도에 따른 수렴활성은 농도 의존성을 나타냈으며, 저농도(100 ㎍/mL) 조건에서 tannic acid(TA)의 수렴활성이 4.98% 일 때, EA 분획물의 활성이 1.25 배 더 높게 나타나 홍경천 뿌리 추출 시 ethyl acetate 용매에 의한 수렴 효능에 기여하는 유효 성분 추출이 다른 용매에 비해 효율적임을 확인하였다. 이러한 결과는 홍경천을 대상으로 열수 추출, 극성에 따른 유기 용매 추출, 초임계 유체 추출 등 다양한 추출법을 적용하였을 때, 각 추출법에 의한 유효성분의 선택성에 따른 건강, 뷰티, 식품 등 다양한 분야에서의 높은 활용 가능성을 시사하는 동시에 동일 소재에 대한 다양한 추출법의 연구 개발 필요성을 나타낸다.
5. Tyrosinase 억제 효과
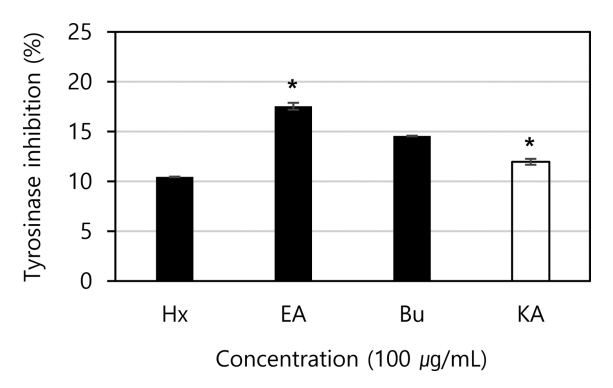
미백 화장품 원료 개발은 tyrosinase 활성 억제, arbutin 유도체 개발, 표피 세포의 turnover 촉진, 멜라닌형성세포(melanocyte)의 성장과 분화 기전 차단, 각질형성세포로의 멜라노좀 전달 억제 등으로 발전되고 있으며, 이 중 tyrosinase 활성 억제 물질은 멜라닌 생성 기전의 최상위 단계에서 기능하는 멜라닌 생성 억제제로 작용한다(Hanif et al., 2020; Norin et al., 2021). 따라서 홍경천 각 분획물의 미백 활성을 확인하고자 시험관 내에서 mushroom tyrosinase 효소에 의한 L-tyrosine 산화 정도를 측정 한 결과, Fig. 5와 같이 EA(17.53%) > Bu(14.55%) > Hx(10.44%) 순으로 tyrosinase 활성 억제능이 관찰되었다. 특히, EA 분획물의 효소 억제능은 양성대조군인 kojic acid (KA)와 유사한 수준(11.963%)으로 나타나 미백 원료로서의 가능성을 확인하였다. 이러한 in vitro 실험 결과를 통한 멜라닌 생성 기전의 이해는 우수한 미백성분 개발의 기초가 되며, 이를 통해 향상된 미백 제품이 개발 될 수 있을 것으로 기대한다.
6. Elastase 저해 효과
백혈구 과립 효소 중 하나인 elastase는 피부 진피 내에서 탄력을 유지하는 단백질 성분인 elastin을 분해하여 주름 및 피부 탄력성의 손실을 유발하므로 elastase 효소 활성을 저해시킴으로써 피부의 주름 생성을 억제할 수 있다(Imokawa & Ishida, 2015). 홍경천 각 분획물이 elastase 효소 활성에 미치는 영향은 Fig. 6과 같이 양성대조군 elastatinal의 elastase 저해능이 56.98% 일 때, 모든 분획물의 농도 100 ㎍/mL 조건에서 EA(45.46%) > Bu(45.07%) > Hx(43.59%) 순으로 EA 분획물에 의한 저해 효과가 가장 높게 나타났다.
IV. 결 론
홍경천은 알츠하이머병(Alzheimer's disease), 파킨슨병(Parkinson's disease), 뇌혈관병(cerebrovasular disease), 당뇨병(diabetes) 그리고 심혈관질환(cardiovascular disease)과 같은 노화와 관련된 질병에 치료 효능이 알려진 약초(medical herb)로 풍부한 폴리페놀 성분을 함유하고 있다. 본 연구에서는 홍경천 뿌리를 소재로 메탄올추출물과 각 용매 별 극성 차에 따른 다양한 분획추출물을 제조하여 화장품 원료로서의 효능을 비교 평가하고자 하였다.
홍경천 뿌리 분말(250 g)에 유기용매인 메탄올 용매를 첨가하여 상온에서 24시간 3회 추출 후 총105 g(수율 42%)의 분말을 얻었으며 이를 n-hexane(Hx), chloroform(C), ethyl acetate(EA), n-butanol(Bu) 등으로 분획을 수행하여 최종 water 분획물을 포함한 총 5가지 시료의 수율은 각각 0.009%, 5.0%, 6.5%, 29.8%, 46.5%로 확인되었다. 홍경천 메탄올추출물과 각 분획물의 항산화 활성을 DPPH, ABTS 라디컬 소거 활성 및 총 폴리페놀 함량 측정으로 확인하였다. DPPH 라디컬 소거능 측정 결과, 모든 시료 농도 의존적으로 소거능이 증가하였으며, EA 분획물의 소거 활성이 가장 높게 확인되었다. 이는 ABTS 라디컬 소거능 결과에서도 동일하게 EA 분획물의 라디컬 소거 활성이 가장 우수한 것으로 나타났다. 또한 메탄올추출물과 각 분획물 내 총폴리페놀 함량 측정 결과, EA 분획물의 총 폴리페놀 함량이 500.48±4.84 mgGAE/g으로 DPPH와 ABTS 라디컬 소거능 결과와 동일하게 높은 수준으로 검출되어 본 연구에서 사용한 n-hexane, chloroform, ethyl acetate, n-butanol 중 항산화제로서 홍경천 뿌리를 활용 시 ethyl acetate 용매 선택이 최적의 추출법이라 사료된다. 홍경천 뿌리 메탄올추출물과 분획물을 대상으로 염증 억제 효능을 평가하고자 NO 생성량, COX2 단백질 발현 수준, IL-6 싸이토카인 분비량을 확인한 결과, LPS에 의해 증가된 NO 생성, IL-6 분비 수준 및 COX2 단백질 발현이 감소하였으며, 특히 ethyl acetate 분획물에 의한 항염증 효능이 우수함을 확인하였다. 마지막으로 피부 수렴, 미백, 주름 문제 개선에 대한 기능성 화장품으로서의 효능을 평가하였다. 그 결과 양성대조군인 tannic acid와 비교하여 ethyl acetate 분획물의 수렴활성이 다른 분획물에 비해 1.25배 높게 나타나 피부 모공 축소 기능의 수렴제로서의 활용이 기대되며, tyrosinase 활성 억제 및 elastase 저해 결과와 더불어 홍경천 뿌리 ethly acetate 분획물은 수렴, 미백 및 항주름 효능의 복합 기능성 화장품 원료로서 가능성이 있음을 시사한다.