I. 서 론
사회가 발전함에 따라 다양한 외인성 항원들이 늘어나면서 아토피 피부염 유병률은 지속적으로 증가하는 추세이다(HanifIn, 1980).
유전적 기전을 가진 아토피 피부염은 만성 재발성 습진성 질환으로 발병의 기전은 다양하다. 현재까지는 공기오염으로 인한 흡입과 음식물 알러지 및 외부항원들에 의해 인체에서 민감하게 반응하는 면역학적 기전으로 알려져 있다(Bak, 2009). 이와같이 외부자극에 의해 가려움증으로 피부를 자극하면 피부 장벽의 손상과 염증 반응으로 이어져 피부염을 악화시키는 원인이 된다(Correale et al., 1999; Ikoma, 2009).
아토피 피부염은 심한 피부소양증을 함께 홍반성 구진과 린설로 시작하여 수포 및 장액성의 물질과 가피를 보이는 피부염증성 질환이다(Aoyama et al., 1995). 피부는 외부자극으로부터 피부를 1차 적인 면역 기관으로 표피는 95%의 각질형성세포로 구성되어 있으며, 이러한 각질형성세포는 분화과정을 통해 피부 장벽 인자들을 생성하여 피부장벽 기능을 수행한다(Zaidi & Lanigan, 2010). 외부자극에 노출되면 백혈구 같은 염증세포가 침윤되면서 면역반응에 중요한 역할을 수행한다(Paller et al., 2000). 이러한 염증반응은 염증 사이토카 생성을 유도하여 각종 염증성 피부질환을 발생시킨다(Homey et al., 2006).
피부질환에 가장 널리 쓰이는 치료제인 국소 스테로이드제는 장기간 사용시, 섬유아세포의 기능을 억제하거나 콜라겐 생성을 저해시켜 상처의 회복을 지연시킬 수 있다(Jackson et al., 2007). 만성피부질환에서 국소 스테로이드 치료제를 장기간 사용 시 발생하는 부작용을 줄이기 위해 일시적으로 사용을 중단하거나 보습제를 병용해야 한다.
박하(Mentha arvensis, cornmint)는 꿀풀과(Lamiaceae)에 속하는 다년생 식물로 한국, 중국, 시베리아 습지에 서식하며, 한국에서는 Mentha arvensis L.로, 중국에서는 M. haploxalys Briq로 기원을 규정하고 있다(Kim et al., 2003). 한국과 중국 간의 기원 종 차이가 존재하는 천연물 중 하나로 박하속에 속하는 수생박하와 녹양박하의 대표적인 허브 식물이다(National Pharmacopoeia Committee, 2010; South Korea college of pharmacy conference, 2007). 박하의 효능으로는 감기로 인한 발열, 두통, 땀이 나지 않는 증상에 사용하고 충혈, 인후염, 편도선염, 피부가려움증, 간 질환, 복통, 설사 구토 등의 효능이 있다(Bae, 2000). 효능으로 해열작용, 소염작용, 담즙분비 촉진 및 위장 평활근 억제 작용, 호흡 기도의 점액분비 증가, 자궁수축 등에 효과적인 것으로 알려진 천연물이다(Choi, 2007). 최근 연구에서 박하잎 오일의 주성분인 멘톨 및 멘톨 유래 화합물이 Epidermophyton floccosum, Trichophyton rubrum등은 무좀을 유발하는 피부사상균에 대해서도 유의미한 항균력을 가진다고 보고되었고(Tung et al., 2008), 생쥐 대식 세포주에서 그람음성 세균의 세포벽 구성물인 LPS 자극에 따른 염증성 매개체인 NO(Nitric Oxide)의 증가를 유의미하게 억제함을 보고하였다(Kim & Kang, 2019). 하지만 아토피 관련 피부염 실험에 대해서는 연구가 미진하여 본 연구자는 아토피 관련하여 HMC-1, RBL-2H3, THP-1, hFCs로 아토피 피부염 염증인자의 실험을 진행하고자 한다.
II. 재료 및 방법
1. 재료
1) 시료
국내산 박하(Mentha arvensis L.)를 대전 동구 약재 시장(Korea)에서 구매하였다. 불순물 제거를 위해 3번 수세하고, 그늘에 말린후 45℃에서 dry oven에서 12시간 건조하였다. 건조된 박하를 분쇄기에서 분쇄한 후 -20℃에서 냉동고에 보관하였다.
2) 박하(Mentha) 추출물 제조
분쇄한 박하 100 g에 90% 에탄올 각각 2ℓ씩 넣고 교반기로 회전하면서 4시간 동안 추출한 후 여과액을 얻어 추출기에서 감압 농축하였다. 농축된 용액을 초저온 냉동고 (-80℃)에서 48시간 동결시킨후 freeze dryer로 3일동안 건조하였다. 10.8 g의 얻었고, 그 분말은 초저온 냉동고(-80℃)에서 보관하여 실험에 따라 필요한 증류수에 희석하여 상층액을 따로 분리하여 주사기 필터(4.5μm)로 여과하여 냉장보관하여 사용하였다(이를 MT로 명명한다).
3) 시약
본 실험에 사용된 시약 중 Diethyl pyrocarbonate, trypsinEDTA, 4-sulfophenyl-2H-tetrazolim, RPMI-1640 배양액, DPBS, EtOH 등은 Sigma사(U.S.A.) 제품을, Taq polymerase와 dNTP는 TaKaRa사 Japan 제품을, 역전사효소와 Cyclosporin A는 중외제약 제품을, RNase inhibitor는 Promega사 제품, 우태아 혈청은 Hyclone사 제품을, DMED은 Gibco사 제품을, RNase는 Pharmingen사 제품을, 인간 재조합 IL-6, IL-8, histamine kit는 R & D system사 제품을, LipofectamineTM 2000 Reagent는 Invitrogen 사 제품을 사용하였으며, 기타 일반 시약은 특급 시약을 사용하였다.
4) 기기
본 실험에 사용된 기기는 열탕추출기(대웅, Korea), 교반기, 감압농축기(Büchi B-480, Switzerland), freeze dryer(EYELA FDU-540, Co., Japan), 배양기(Forma scientific Co., U.S.A.), clean bench(Vision scientific Co., Korea), 멸균기(Sanyo, Co., Japan), spectrophotometer(Shimazue, Co., Japan), 원심분리기(한일. Korea), ELISA reader, 7500 Fast Real-Time PCR system(Applied Biosystems, Co., U.S.A.), flow cytometer 등을 사용하였다.
2. 방법
1) 세포 배양
HMC-1(Human mast cell line) 5×105/㎖, THP-1(human acute monocytic leukemia cell; 미국 세포주은행) 2×105/㎖, RBL2H3(mast cell line) 5×105/㎖ 세포를 DMEM, antibiotics와 10% FBS를 넣고, 37℃ CO2 배양기에서 3일간 배양하였다.
Human fibroblast cell(hFCs)은 성인 피부에서 분리한 인간 진피 섬유아세포(cat. C-013-5C)를 gibco, Inc(Gibco, Grand Island, NY, U.S.A.)에서 구입하여 사용하였습니다.
2) SRB assay
세포독성 측정은 SRB assay을 사용하였다. HMC-1, THP-1, hFCs에 37℃, 5% CO2의 환경의 배양기에서 자란 세포를 trysin-EDTA 용액을 이용하여 세포를 떼어낸 후, 2×104개 세포로 96 well plate에 분주한 후 배양하였다. 배양 후 MT 1000, 500, 250, 125, 62.5, 31.2 ㎍/㎖를 48시간 동안 처리하였다. 배양 종료 후에 PBS로 2회 세척한다. 각 well에 50% TCA를 50 ㎕을 넣고 1시간 동안 4℃에 방치한 후 증류수로 세척한 다음 공기 중에서 건조하였다. 여기에 SRB 용액을 100 ㎕/well로 처리하고, 30분간 실온에서 염색하고 0.1% acetic acid 용액으로 약 4~5회 washing 후 상온에서 건조하고 10 mM tris base로 100 ㎕/well로 용해시켰다. 540 ㎚에서 흡광도에서 ELISA reader를 측정하였다.
3) Real Time Quantitative RT-PCR
(1) Human mast cell line(HMC-1) 배양
HMC-1(Human mast cell) 세포를 2×106/㎖로 DMEM과 DNase type-I, antibiotics 10 ㎎/㎖, amphotericin B과 2-mercaptoethanol을 넣고 37℃ CO2 배양기에서 3일간 배양하였다.
(2) RNA 추출
HMC-1를 plate에 5×104 cell/㎖로 배양하고, 여기에 MT 200, 100, 10 ㎍/㎖, 양성대조군 CsA (10 ㎍/㎖)를 처리하였다. 1시간 후 PMA(50 ng/㎖)와 A23187(0.5 μΜ)를 well에 첨가하여 CO2 배양기에 24시간에 배양한 후 원심분리 하였다. 상층액을 제거하고, RNAzolB 500 ㎕를 넣어 MiX 한후, chloroform 50 ㎕를 넣고 15초동안 MiX하고 얼음은 이용하여 0℃ 이하에서 15분 후 13,000 rpm에서 원심 분리한다. 200 ㎕의 상층액을 2-propanol 200 ㎕와 동량 혼합 후 천천히 흔들고 얼음은 이용하여 0℃ 이하에서 15 분간 방치하였다. 혼합용액을 원심 분리를 13,000 rpm에서 한 후 80% 에탄올에서 세척하고 3분간 vaccum pump에서 건조를 진행하여 RNA를 추출하였다. 분리한 RNA는 DEPC를 처리한 20 ㎕의 3차 증류수에 녹여 75℃에서 불활성화한 후 first strand cDNA 합성에 사용하였다.
(3) 역전사-중합효소 연쇄반응
역전사-중합효소 연쇄반응은 준비된 Total RNA 3 ㎍을 DNase-I을 2U/tube 37℃에서 30분간 반응한 후 75℃에서 10분간 변성시켰다. 여기에 2.5 ㎕ 10 mM dNTPs를 Mix하고, 1 ㎕ random sequence hexanucleotides를 RNA inhibitor로 1 ㎕ DTT(100 mM), 4.5 ㎕, RT buffer×5를 첨가한 후, 1 ㎕의 MMLV RT를 Mix하여 DEPCrk 처리된 증류수로서 최종 20 ㎕가 진행하였다.
20 ㎕의 반응한 혼합액을 잘 섞은 뒤 5초간 2,000 rpm에서 원심분리하여 37℃ 60분간 반응하여 first-strand cDNA를 합성하였다. 합성된 first-strand cDNA 95℃에서 5분, M-MLV RT를 불활성화시키고, cDNA를 PCR에 사용하였다.
(4) Real Time Quantitative RT-PCR
HMC-1으로부터의 RNA는 TRI 시약으로 분리한다. DNase I로 염색체의 DNA을 제거하고 진행하였다. 75℃에서 20분간 DNase과 5 ug을 Mix하여 total RAN은 First Strand cDNA Synthesis kit로 진행하였다.
Real-Time PCR은 Applied를 사용하였다. Probes는 6-carboxyfluorescein으로 beta-actin cDNA는 같은 양을 포함하고, 각 cDAN 표본을 AmpliTaq Gold DNA Polymerase을 포함시켜 증폭시켰다. PCR 조건은 40 cycles를 50℃에서 2분동안 95℃과 10분동안 60℃에서 15초동안 진행하였다. 사용된 probe는 아래와 같다.
4) THP-1 세포에서 IL-6, IL-8 측정
THP-1 세포를 0.5% FBS/RPMI에 2.0×106/m로 well plate에 분주한 후 배양기에서 배양하였다. 배양 후 MT 200, 100, 50 ㎍/㎖를 24시간 동안 처리한 후 배양한 집먼지 진드기 (HDM)를 24시간 동안 반응하여, ELISA를 이용하여 상층액에서 염증 사이토카인 IL-6, IL-8를 측정하였다.
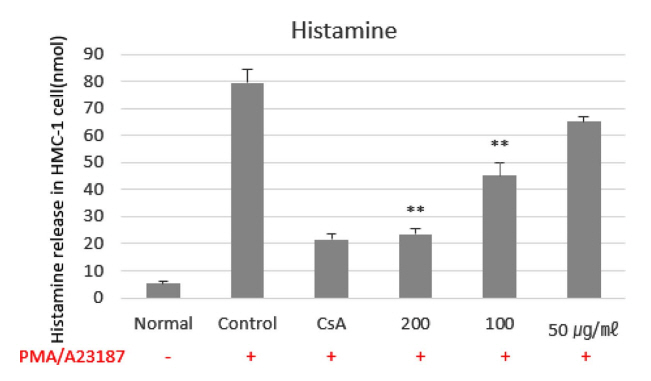
5) Histamine 분비량 측정
HMC-1을 5×104 cell/㎖로 배양하였다. MT 200, 100, 10 ㎍/㎖, 양성대조군으로 CsA(10 ㎍/㎖)를 처리하고, 1시간 후 PMA와 A23187를 well에 첨가하여 CO2 배양기에 24시간에 배양하였다. 각 항체 anti-IgE를 coating buffer 용액으로 희석하여 micro well에 coating을 진행한 후 4℃에서 30분간 방치한다. ELISA reader 450 nm에서 histamine 분비량을 측정하였다.
6) β-Hexosaminidase 분비량 측정
RBL-2H3를 5 x 105 cell/㎖로 plate에 배양하고 tyroid buffer로 세척하였다. MT 200, 100, 10 ㎍/㎖을 1시간동안 전처리하고 양성대조군을 15분동안 A23187을 처리한 뒤 1 mM pnitrophenyl-N-acetyl-β-glucosamide 50 μl를 30분 동안 배양기에서 반응시켰다. 1N HCl을 넣어 반응을 정지시키고, 405 nm에서 분비량을 측정하였다.
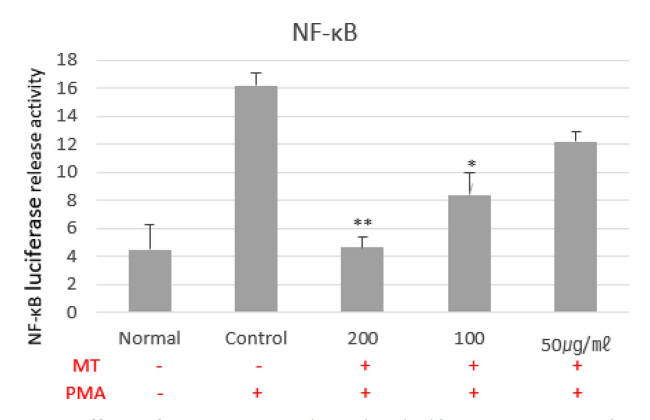
7) NF-κB promoter 활성 측정
RBL-2H3를 5×105 cell/㎖로 18시간 배양한 후, FBS와 antibiotics를 세척하고, 배양액으로 바꾼다. NF-κB-Luc vector b-galactosidase assay를 통해 pCMV-β-Luc vector를 4시간동안 형질전환을 하였다. FBS와 antibiotics가 함유된 배양액을 첨가하여 MT 200, 100, 10 ㎍/㎖에 양성대조군인 PMA를 18시간동안 배양한후 lysis buffer로 세포를 용해시켰다. 3번의 급속 냉동-해동을 진행하여 세포를 파괴시킨후, 원심분리를 12000 rpm에서 5분동안 진행하여 세포 추출물을 얻고 여기에 luciferase substrate와 반응하여 NF-κB promoter 활성을 측정하였다.
III. 결과 및 고찰
1. 세포독성에 미치는 영향
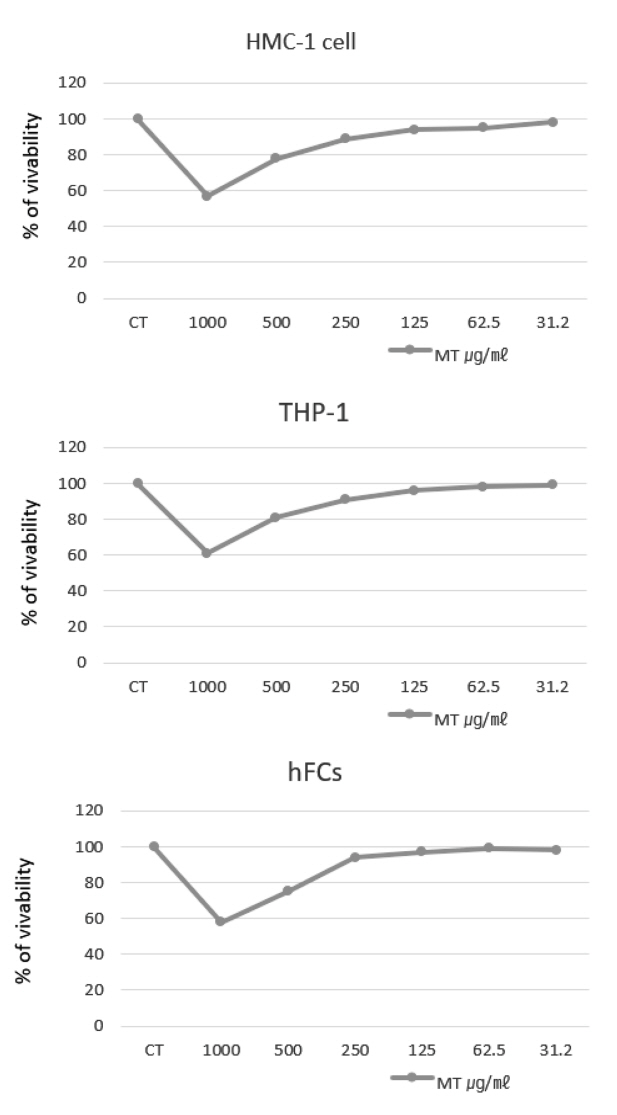
MT가 HMC-1 (Human mast cell line), THP-1 (human acute monocytic leukemia cell), hFCs (Human fibroblast cell)의 실험에 독성을 나타내지 않는 농도를 설정하기 위하여 세포독성을 측정한 결과, HMC-1에서는 1000, 500, 250, 125, 62.5, 31.2 ㎍/㎖ 농도에서 생존율이 각각 57.2±0.16, 78.4±0.11, 90.2±0.13, 94.5±0.12, 95.2±0.16, 98.2±0.21%로 나타났고, THP-1에서는 1000, 500, 250, 125, 62.5, 31.2 ㎍/㎖ 농도에서 생존율이 각각 61.4±0.21, 81.8±0.17, 91.5±0.31, 96.4±0.25, 98.1±0.15, 99.2±0.12%로 나타났고, hFCs에서는 1000, 500, 250, 125, 62.5, 31.2 ㎍/㎖ 농도에서 생존율이 각각 58.2±0.24, 75.8±0.31, 94.7±0.24, 97.1±0.31, 99.1±0.24, 98.7±0.17%로 나타나, 250 ㎍/㎖ 이하 농도에서는 90% 이상의 생존율을 나타내어 이보다 200 ㎍/㎖이하 농도에서 실험에 적용하였다(Fig. 1).
2. 사이토카인의 발현 양상
1) IL-8에 미치는 영향
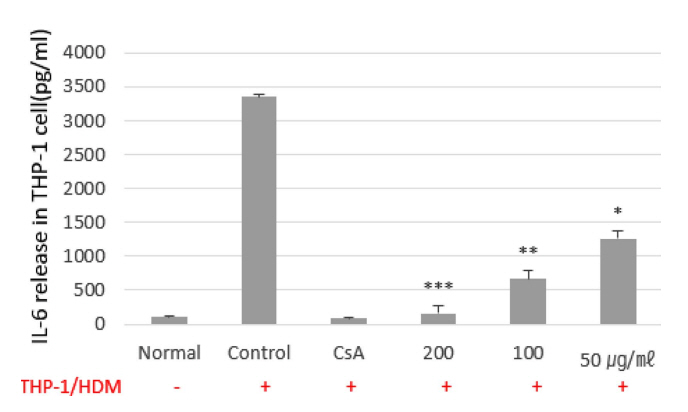
HMC-1에 PMA와 A23187을 처리한후, MT를 농도 별로 처리하여 분석한 결과, IL-8 mRNA 유전자 발현은, 대조군의 RQ값이 1 일때, CsA는 0.609로 나타났으며, MT 200, 100, 50 ㎍/㎖에서는 각각 0.045, 0.316, 0.354로 나타나 대조군에 200 ㎍/㎖에서는 유의성 있는 효과를 나타내었다(Fig. 2). 사람의 단핵구인 THP-1 세포에서 IL-8 생성을 측정한 결과, 정상군은 101.3±14.1 (pg/㎖), 대조군은 3352.5±45.0 (pg/㎖), 양성대조군인 dexamethasone 투여군은 85.2±21.4 (pg/㎖)을 나타내었고, MT 200, 100, 50 ㎍/㎖ 농도 투여군은 1283.21±104.1, 2954.1±94.2, 3824.0±131.2 (pg/㎖)로 대조군에 비하여 생성량이 감소되었고, 200 ㎍/㎖ 농도에서 유의성 있는 억제를 나타내었다(Fig. 3). THP-1 cell은 monocyte의 자극을 받게 되면 proatherogenic molecule들에 의해 내피세포 안으로 들어가 macrophage로 분화하여 면역작용을 하게 되며(Theoharides & Cochrane, 2004), DPE로 자극하면 IL-6, IL-8의 발현이 증가로 관련성을 나타내었다(Lee et al., 2008). IL-8은 염증 부위에서 호중구를 끌어 모아 염증을 악화시키고, 초기염증에 중요한 케모카인으로 알러지 질환을 증가시키지만, 스테로이드에 의해 억제된다(Bickel, 1993). 또한, histamine 발현을 증가시켜 피부염을 악화시키며(Russo et al., 2014), 각질형성세포에서 생성되는 염증성 사이토카인으로 아토피 피부염과 같은 염증성 질환을 일으키는 중요한 역할을 하므로(Amarbayasgalan et al., 2013) IL-8 분비억제는 피부장벽 손상을 억제하는 것으로 사료된다.
2) IL-6에 미치는 영향
HMC-1에서 IL-6 mRNA 유전자 발현은 대조군 RQ값이 1 일 때, CsA는, 0.254로 나타내었고, MT 200, 100, 50 ㎍/㎖에서는 각각 0.349, 0.512, 0.859로 나타내었다(Fig. 4). THP-1에서 IL-6의 측정 결과는, 정상군은 101.4±14.1 (pg/㎖), 대조군은 3352.5±45.0 (pg/㎖), 양성대조군인 dexamethasone 투여군은 85.2±21.4 (pg/㎖)로 나타내었고, MT 200, 100, 50 ㎍/㎖에서는 158.75±106.5, 667.5±131.1, 1257.5±123.6 (pg/㎖)로 대조군에 비하여 생성량이 감소되었고, 200 ㎍/㎖ 에서 유의성 있는 생성억제를 나타내었다(Fig. 5). 아토피 피부염은 Th2 세포의 활성이 IgE 증가로 나타나는 피부 질환이다(Jo & Choi, 2022). IL-6는 선천성 면역과 적응면역에서 기능을 하는 사이토카인으로 조직 손상에 대한 발열반응을 초래한다(Liu et al., 1998). Th2 세포에 의해 분비되는 염증성 사이토카인들은 각질형성세포와 피부 세포에 영향을 미친다(Berke et al., 2012). 각질형성세포는 피부의 가장 바깥쪽에 존재하는 세포로 각질형성세포의 각질은 피부보호 장벽기능을 담당하고 있다(Dinarello et al., 1990). 피부장벽이 손상시 외부의 항원이 피부 조직에 침투하면 염증 반응을 통해 IL-6와 같은 염증 사이토카인을 유도하여 만성 피부 염증 질환을 유발을 한다(Eckert, 1989; Cha et al., 2017). 이에 IL-8 및 IL-6을 생성 억제는 T 세포 및 호중구가 표피로 유입되는 것을 막아 피부장벽 손상을 억제한다고 볼수 있다(Jo & Choi, 2022).
이러한 결과는 IL-6 및 IL-8이 비만세포와 단핵구외에도 호중구, 호산구에 영향을 미쳐 염증 사이토카인을 억제함으로써 알레르기 염증에 대한 강력한 면역 억재 제로서의 가능성 나타내었다. IL-6 및 IL-8은 표피를 구성하는 케라틴형성 세포에서 주로 발현되는 표피 염증성 사이토카인으로 병원성 미생물의 감염에 대응하여 피부를 보호할수 있는 것으로 사료된다.
3. Histamine 분비량에 미치는 영향
비만세포인 HMC-1을 PMA, A23187로 자극하여 측정한 histamine양은 5.2±0.8 (nmol), 대조군 79.7±4.9 (nmol)로 나타나 정상군에 비하여 대조군이 큰 폭으로 증가하였다. 반면 양성대조군인 CsA 투여군은 21.6±2.1 (nmol)로 나타나 유의성 있는 감소를 나타내었고, MT 200, 100, 50 ㎍/㎖ 투여군에서는 각각 23.6±1.8, 45.2±8.6, 65.1±1.7 (nmol)로 나타나 200, 100 ㎍/㎖에서 유의성 있는 감소효과를 나타내었다(Fig. 6). Histamine 측정은 알레르기 억제물질의 생물활성을 측정하는데 사용하고 있으며, 비만세포의 활성화에 대한 탈 과립(degranulation)의 지표로 알려져 있다(Mekori & Metcalfe, 2000). Histamine은 비만세포의 과립으로부터 빠르게 유리되는 화학 매개체물질로 말초 혈관에 대한 투과성이 높아 점막표면에 대한 선상세포의 분비, 항진작용 등의 과민반응을 나타내며 염증반응을 유발한다(Warner et al., 1999). 히스타민에 의한 염증반응은 외부의 항원에 노출되면 Th-2 세포분화가 유도되어 침윤된 비만세포의 표면에 존재하는 IgE 수용체에 결합을 통해 염증성 화학전달물질인 Histamine과 leukotriene 생성을 촉진하고 염증성 사이토카인의 활성을 증가시켜 피부염증을 초래한다(Lee et al., 2012). 이에 MT의 Histamine 억제효과는 IL-6와 IL-8과 함께 피부염증 감소에 영향을 미치는 것으로 사료된다(Fig. 6).
4. β-Hexosaminidase 분비량에 미치는 영향
MT에 의한 β-Hexosaminidase 분비량을 측정한 결과, 대조군인 A23187에 의해 방출되는 β-Hexosaminidase 분비량의 MT에 의한 inhibition 비율이 MT 50 ㎍/㎖ 농도에서는 10.4%, 100 ㎍/㎖ 농도에서는 21.7%, 200 ㎍/㎖ 농도에서는 50.8%로 유의성 있게 억제하였다. MT에 의한 β-Hexosaminidase IC50 값은 196.85 ㎍/㎖로 나타내었다(Table 1). β-hexosaminidase는 비만세포와 basophil의 histamine이 저장된 과립 내에 존재하고 있으며(Jeon et al., 2009), 탈 과립시에 Histamine과 함께 세포밖으로 분비되는 물질로 β-hexosaminidase의 정량은 비만세포에서 탈과립의 지표로 알려져 있다(Matsubara et al., 2004). 비만세포의 메커니즘을 이용하여 인체의 알레르기 억제의 확인을 위해 인체유래의 비만세포인 HMC-1를 사용하여 실험을 진행한 결과, 농도 의존적으로 감소함을 나타내어 Histamine과 함께 피부염증 감소에 영향을 미치는 것으로 사료된다.
5. NF-κB promoter 활성에 미치는 영향
MT에 의한 NF-κB promoter 활성 억제 효과를 실험한 결과, 정상군은 4.5±1.8로 나타난 반면, 대조군 16.2±2.9로 증가하였다. MT 200, 100, 50 ㎍/㎖ 투여군에서는 각각 16.2±2.8, 8.4±1.6, 12.2±0.7로 200, 100 ㎍/㎖에서 유의성 있게(*p<0.01) 감소하였다(Fig. 7). NF-κB 신호는 염증성 사이토카인의 자극으로 인해 NF-κB 경로가 활성화되며(Lawrence, 2009), NF-κB에서의 탈부착 및 프로테아좀에 의한 IκBα의 최종적인 분해를 초래하여 분리된 NF-κB는 세포질에서 핵 내로 이동하여 염증성 사이토카인을 유도하여 염증 반응을 촉진한다(Celec, 2004). NF-κB promoter 억제는 IL-6와 IL-8과 함께 피부염증 억제에도 영향을 미치는 것으로 사료된다.
V. 결 론
MT가 아토피 피부염에서 염증성 기전에 관여하는 사이토카인 IL-6, IL-8, histamine, β-hexosaminidase, NF-B에 미치는 영향에 대해 다음과 결론을 얻었다.
1. Human fibroblast cell (hFCs)에 대하여 250 ㎍/㎖ 이하 농도에서 독성을 나타내지 않아 MT는 200 ㎍/㎖ 이하의 농도에서 실험을 진행하였다.
2. HMC-1에서 IL-8, IL-6 mRNA 발현은 대조군에 비하여 유의성 있게 억제하였으며, THP-1에서도 IL-6, IL-8 생성량은 대조군에 비하여 유의성 있게 MT가 억제하였다.
4. HMC-1에서 histamine 분비량은 대조군에 비하여 MT가 유의성 있게 감소하였다.
5. β-Hexosaminidase 분비량을 50 ㎍/㎖, 100 ㎍/㎖, 200 ㎍/㎖ 농도에서 MT가 10.3%, 21.7%, 50.8% 억제하였으며, IC50 (μg/㎖)은 196.85 μg/㎖로 나타내었다.
6. NF-κB promoter 활성을 대조군에 비하여 유의성 있게 MT가 감소하였다.
이상의 결과로 보아 MT가 아토피에 관련된 항염증성 인자에 효과를 나타내어 피부염에 대한 효과를 확인할 수 있었고, 특히 피부염증에 효과적이므로, 장기간 사용하는 제품에 적극적으로 활용한다면 스테로이드 제제의 단점을 극복하고 피부 장벽 개선에 효과적일 것으로 사료된다.






 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print